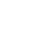药物分析
乙肝病毒宿主结合蛋白的发现
乙肝在我国有非常庞大的患者群体,而乙肝患者如果长期得不到缓解,出现肝硬化的表现,最终可能向肝癌发展。而针对乙肝发病的元凶——乙型肝炎病毒(HBV)的研究还远远不够。乙型肝炎病毒X.基因(HBx)是HBV基因组的四个开放阅读框之一,可编码17kDa的蛋白质,科学家已经发现HBx的变异与肝细胞癌(HCC)进展密切相关。然而,目前基于全长HBx序列的基因型和基因型分类研究,还不能做到使用HBV基因对HCC的进展进行预判。华盈生物合作伙伴-东方肝胆外科医院周伟平教授团队,采用了测序技术成功发现了HBx新的突变基因型HBx-E2,证实了该突变可作为HCC诊断的新biomarker。通过人类蛋白质组芯片技术进一步发现了HBx-WT可结合宿主蛋白JAK1, 而HBx-E2不能结合JAK1蛋白,进而HBx-E2不能够通过激活JAK1-STAT通路进一步促进HCC的发生,使得HBx-E2基因型HCC病人获得更好的预后。该研究不仅发现了新的HCC预后诊断标志物基因,并对该基因调控预后的详细机理进行了阐述,相关成果近期发表在国际顶级学术期刊《Journal of Hepatology》(PMID: 30654066)上。
华盈视角解读⇩⇩⇩
1. 发现集:组织样品中发现HBx变异与HCC进展相关和预后相关
乙型肝炎病毒X基因(HBx)的遗传变异经常发生,临床上观察到该变异与肝细胞癌(HCC)进展密切相关。然而,目前基于全长HBx序列的基因型和基因型分类仍然不能预测HBV对HCC进展的影响。
为了改善这一现状,作者先使用primarycohort(发现集,组织样本,n=284)对HBx DNA进行测序和聚类分析,将全长HBx基因的基因型进行分类。在发现集队列中,通过对肿瘤和非肿瘤组织样品中的HBx DNA中的变体基因座的聚类分析鉴定了三种HBx基因型:HBx-EHBH1,HBx-EHBH2和HBx-EHBH3(图1)。红色表示突变,蓝色表示无突变。
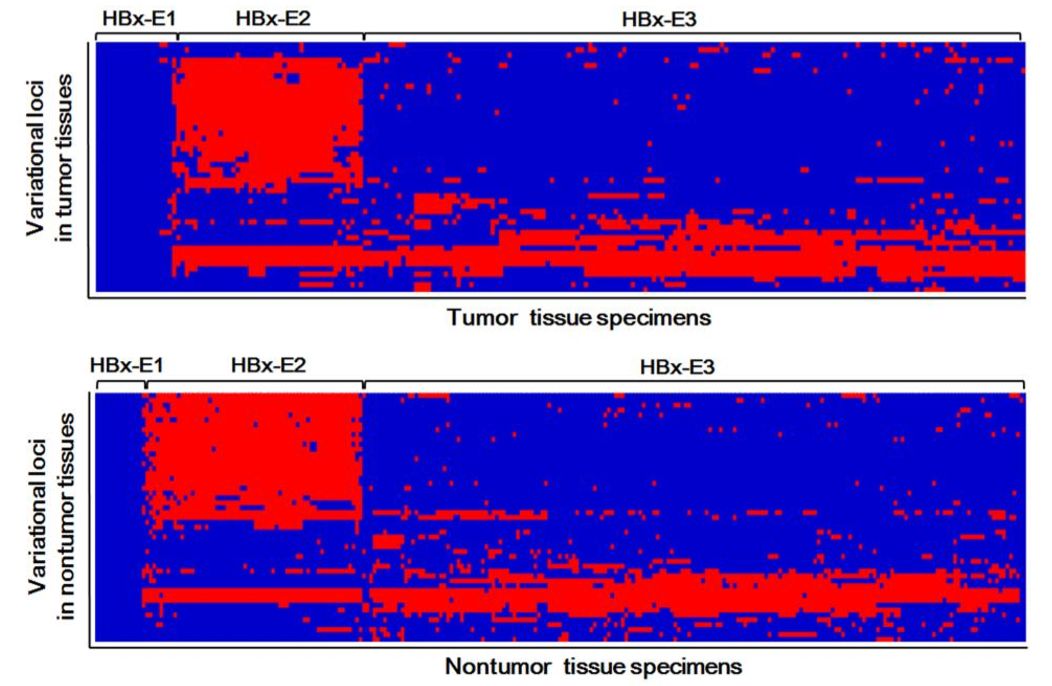
图1 HBx DNA中变体基因座聚类分析
进一步通过生存率曲线分析,发现携带HBx-EHBH2(HBx-E2)基因型HCC患者的无复发生存期(RFS)和总生存期(OS)更好(图2)。
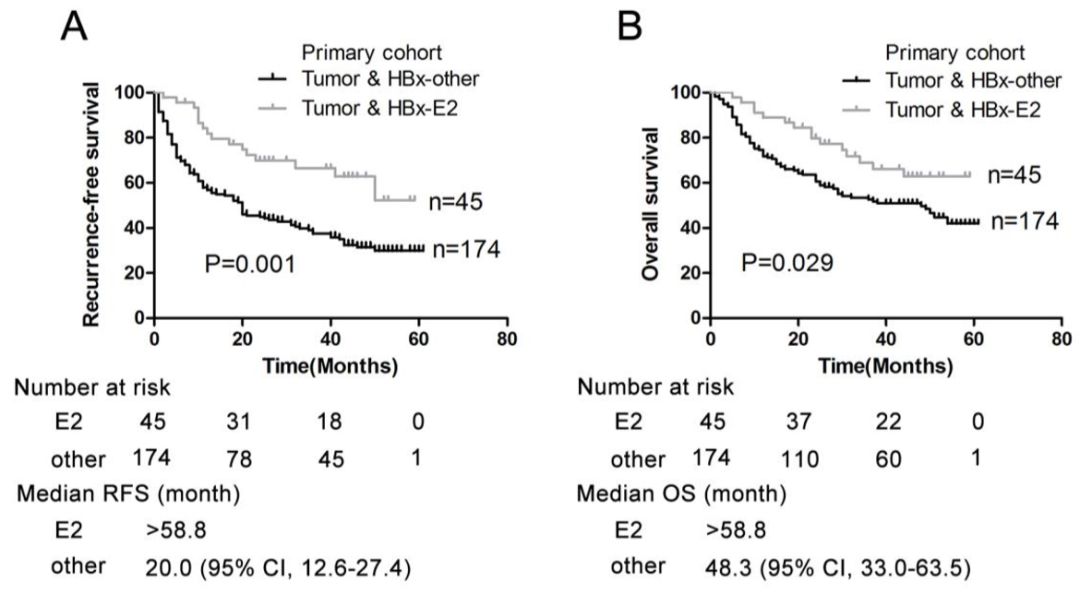
图2 发现集HBx-E2基因型的生存率更好
2. 验证集:血清+组织样品验证HBx-E2基因型HCC预后更佳
作者后续利用validation cohort(验证集,组织,n=171;血清,n=168)对训练集结果进行检测验证。通过对组织样本分析发现:HBx-E2基因型在BCLC B(巴塞罗那分期,B期)的预后诊断效果更显著,同时,HBx-E2基因型携带者预示着更高的生存率(图3)。
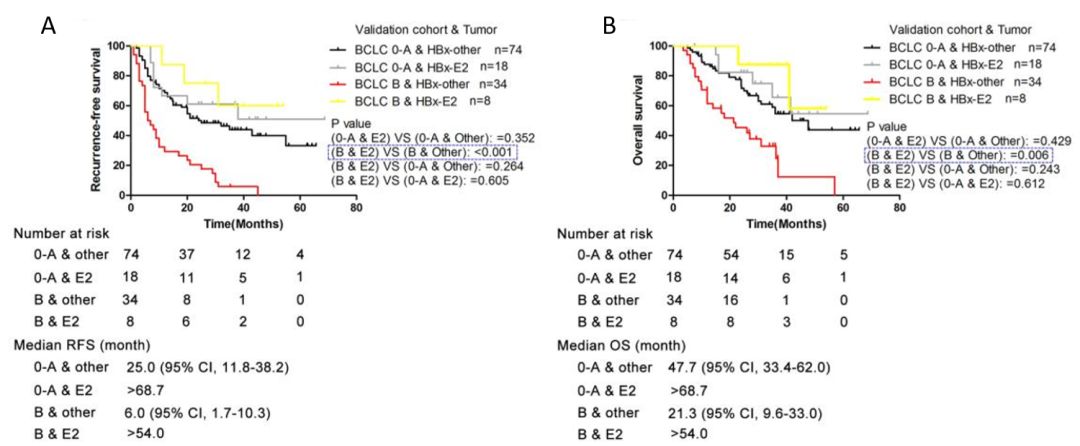
图3 HBx-E2较适用于BCLC B期
由于血清样品相较于组织更容易收集获取,更利于检测标志物,研究人员进一步检测血清中的HBx-E2基因型,发现HBx-E2携带者的无复发生存期(RFS)和总生存期(OS)也更好。而且同样在BCLC B期患者中p<0.05,这对TACE(肝动脉化疗栓塞术:BCLC B期患者建议治疗方法)治疗后患者的预后评估有非常重要的意义(图4)。
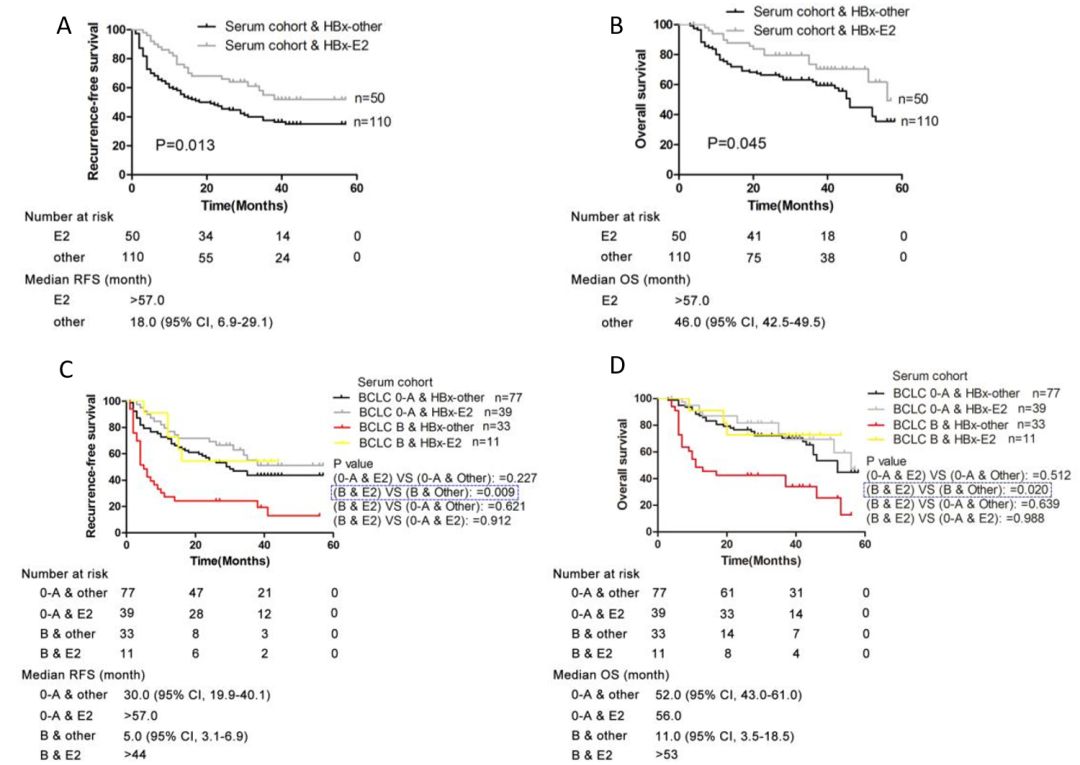
图4 血清基因型生存率差异
3. 细胞动物层面验证不同基因型功能
为了证明HBx的各个基因型功能,作者用HBx-WT序列的相应位点替换为HBx-E2基因型变体的非同义基因座,获得HBx-E2-非同义(HBx-E2-N)序列。通过用HBx-E2的变体位点的同义基因座取代HBx-WT序列的相应碱基,获得HBx-E2-同义(HBx-E2-S)序列,进行了后续的一系列实验。
细胞和动物实验的结果均显示HBx-E2和与其同义的HBx-E2-N在体外和体内丧失了促进HCC增殖,细胞周期和凋亡的能力,但具体它是通过什么途径介导的尚不明确(图5)。
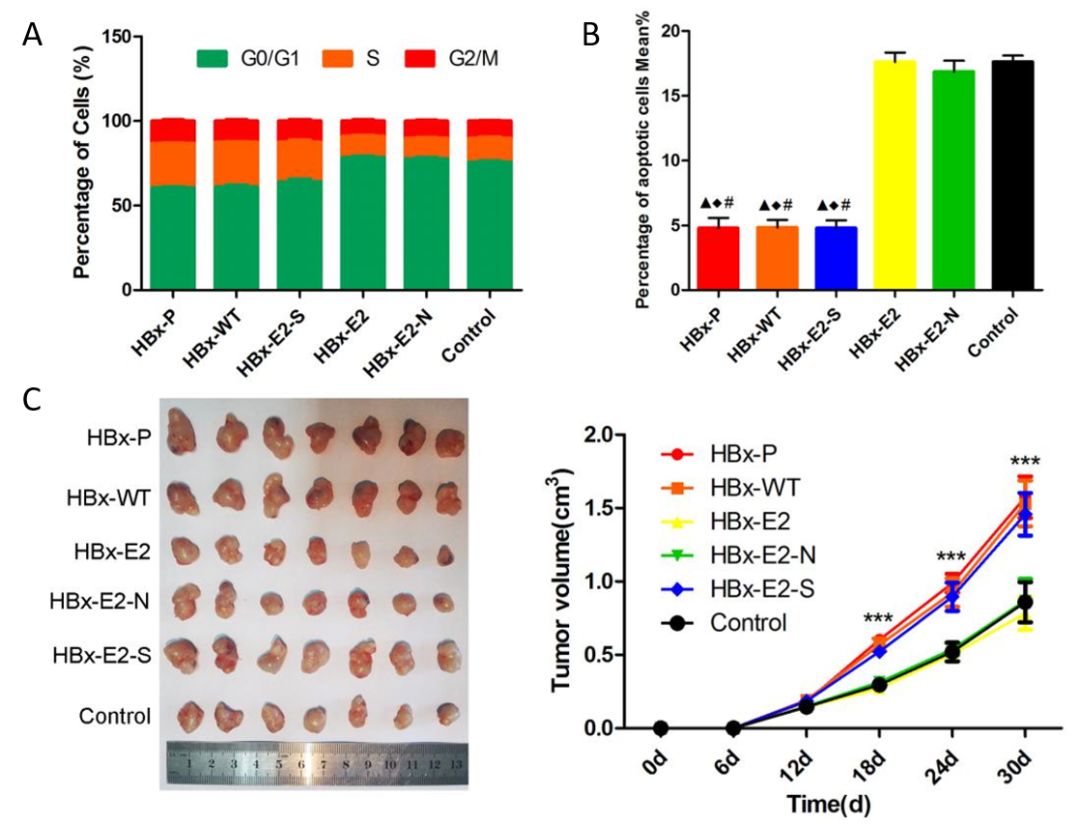
图5 不通基因型在动物细胞层面的影响
4. 通过人类蛋白质组芯片找到HBx-WT与HBx-E2的差异互作蛋白
为找到阐明HBx-E2和与其同义的HBx-E2-N基因型丧失促进HCC增殖,细胞周期和凋亡能力的原因,作者对HBx-WT和HBx-E2这两种蛋白的直接结合蛋白进行探索,寻找它们各自特有的互作蛋白。首先体外重组表达了这两种基因型蛋白,并与华盈生物合作,采用Huprot 20K人类蛋白质组芯片(覆盖2万种人类全长蛋白)技术,快速找到了42种蛋白质可与HBx-E2和HBx-WT相互作用。其中,有16种蛋白质只与HBx-WT基因型相互作用。16种结合蛋白中的三种(JAK1,RBBP4,CAP2)与HCC的发生与发展相关。而JAK1作为将细胞因子信号转导至STAT的分子,在细胞增殖中起关键作用。因此,作者后续选择了JAK1进行验证,通过进行CO-IP加WB、免疫荧光共定位等实验证明了HBx-WT蛋白与JAK1之间确实存在物理相互作用。(图6)
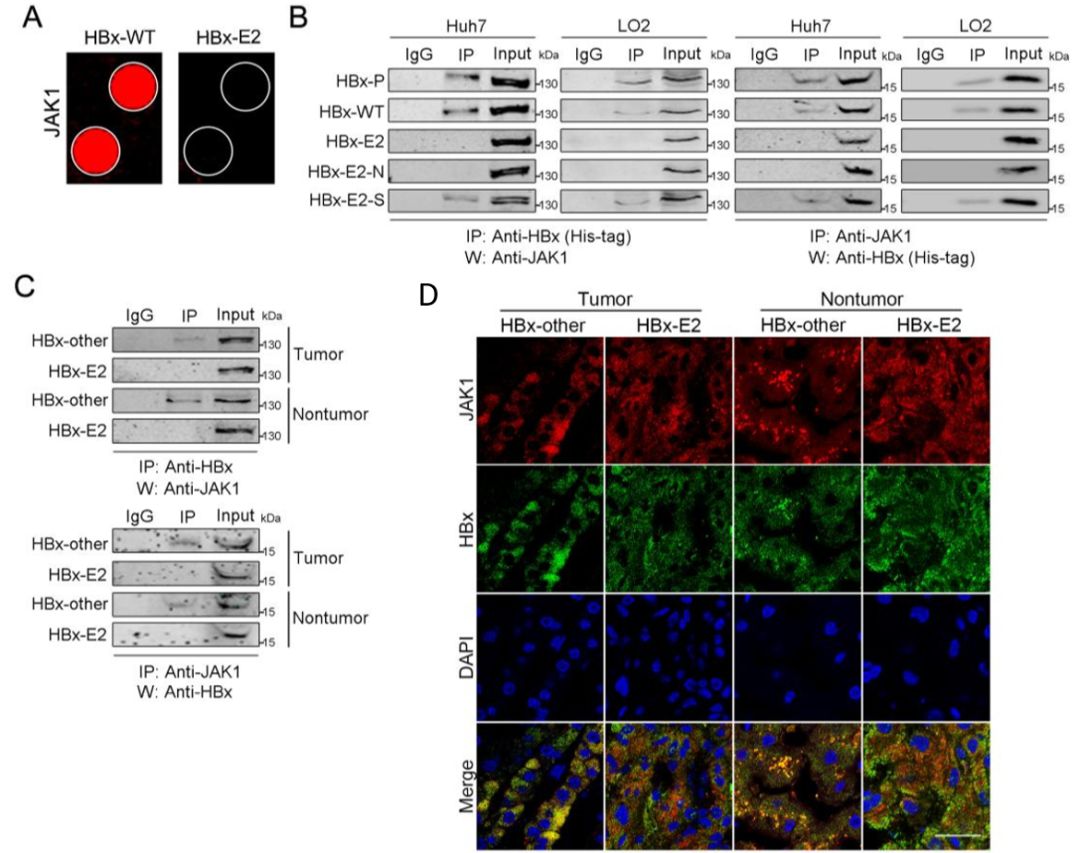
图6 互作蛋白筛选及验证
5. JAK-STAT信号通路调控机理
HBx-WT已经通过人蛋白质组芯片及相关实验证明可与JAK1相互作用,那么它是否会影响其活性等进而影响整个JAK-STAT通路呢?
WB和IHC显示JAK1、STAT3、STAT5的磷酸化水平活性在HBx-E2和HBx-E2-N中明显下降(图7),可见HBx-E2对JAK-STAT通路激活能力明显下降,而JAK / STAT信号通路与细胞的增殖,细胞周期,凋亡和分化密切相关。
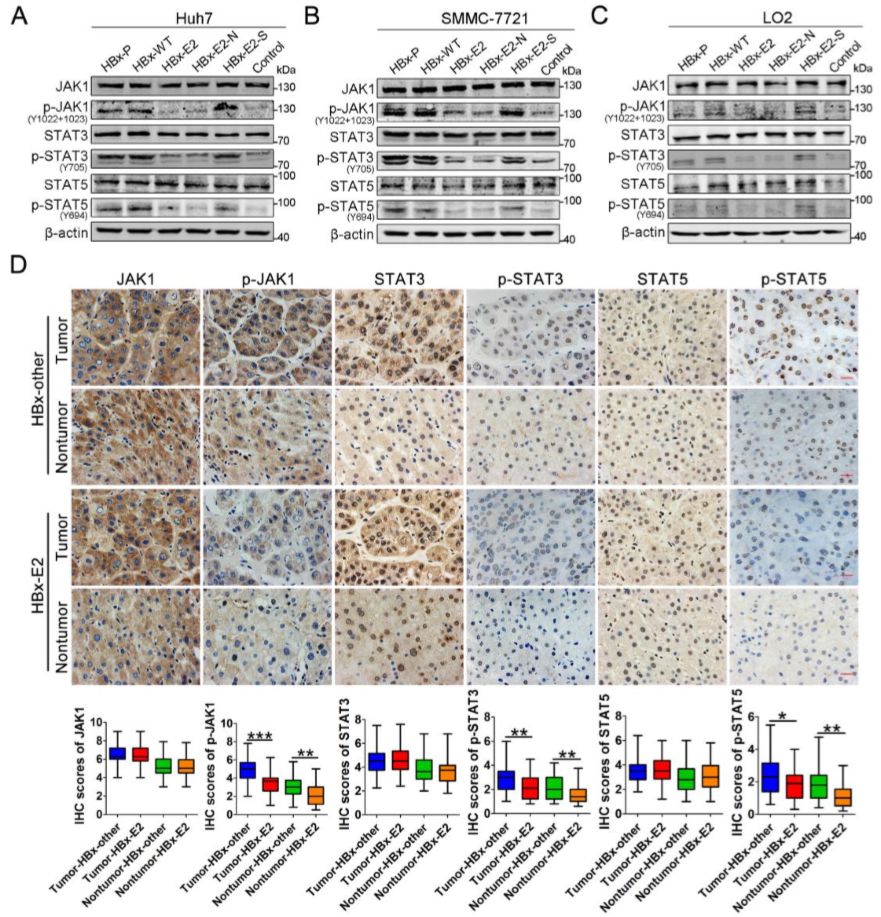
图7 WB及IHC等验证JAK-STAT通路
所以作者最终提出机制假说:HBx-WT变异为HBx-E2后,其表达的蛋白失去与JAK1相互作用,进而失去了激活JAK1 / STAT通路的能力,最终导致细胞增殖受阻(机制原理见图8)。
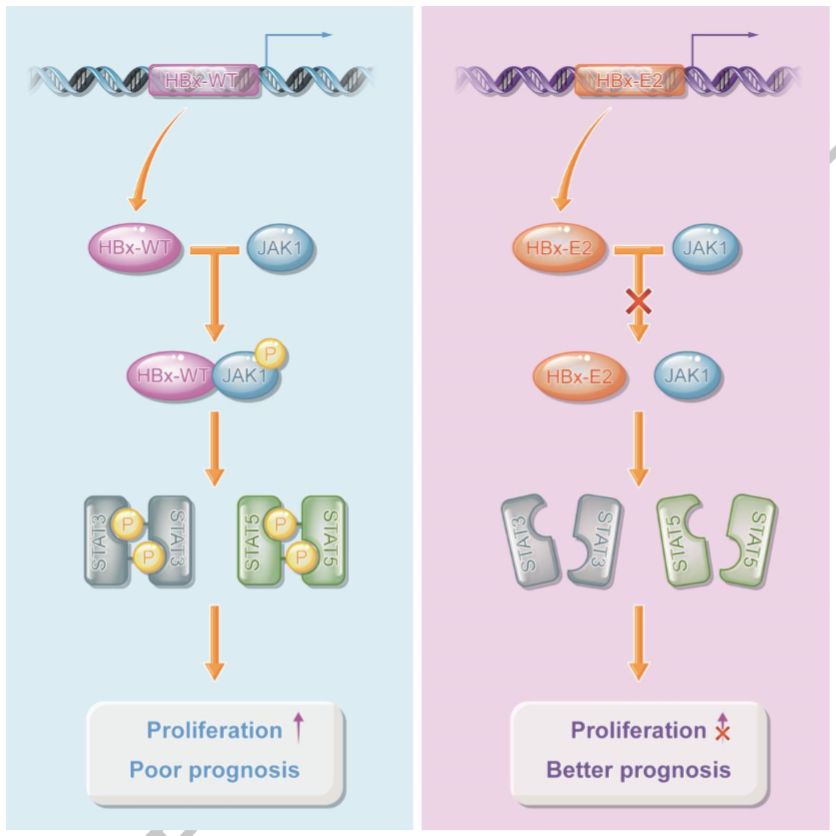
图8 机制原理图
| 小结
综上所述,在本研究中,作者通过测序发现了新的HBx突变基因型,并构建对应的同义和非同义序列,证明其功能,最终利用人类蛋白组芯片技术快速找到了相较于突变体HBx-E2,HBx-WT特有的多个直接结合蛋白,快速锁定到与HCC密切相关的JAK-STAT通路上游分子JAK1蛋白。这对于后续解释HBx-WT基因变异导致肿瘤进展受阻机理至关重要,大大缩短了实验周期,为机制解释指明了方向。
纵观全文,作者的思路非常清晰,从发现集中发现新的基因型,进一步分析发现其对中期HCC具有预后评估意义,验证集加入血清样品重视临床可行性,更难得的是进一步进行功能及机制研究,阐明了HBx-E2基因型携带者具有更好预后的原因。该研究思路清晰,实验设计严谨,技术路线经典(图9),值得华盈视角推荐。
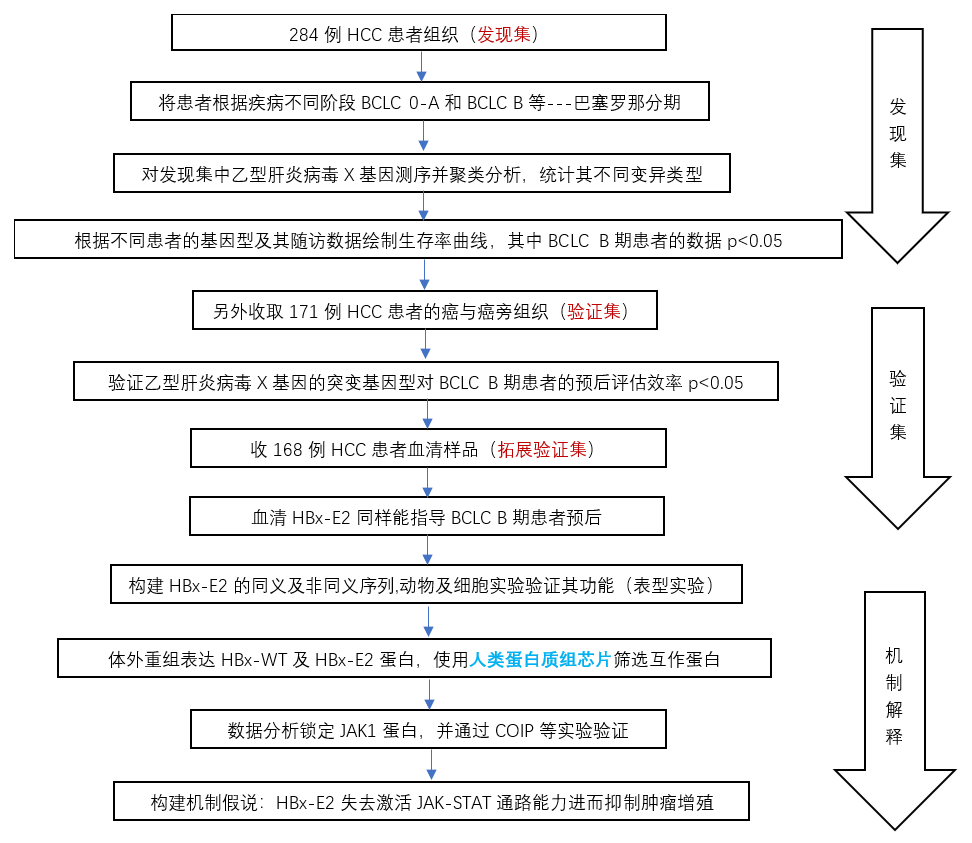
图9 全文技术路线图
在机制探索方面,作者利用华盈生物推出的人类蛋白组芯片技术,筛选互作蛋白,几周内快速锁定了JAK1蛋白,效率之高远超传统技术。人类蛋白组芯片在筛选互作蛋白研究中具有如下特征性优势:
1. 芯片实验为体外实验,芯片上每个蛋白点相互独立,保证筛选到的互作蛋白均为目标蛋白的直接结合蛋白,数据分析简单。
2. 体内环境复杂,很多蛋白结合现象稍纵即逝,并且蛋白表达存在空间和时间上的差异,利用体外环境条件下的筛选,可以很快发现很多潜在结合靶标,结合每个蛋白的生物学功能再进行后续实验验证的实验策略更加高效,数据也更加全面。
3. 在不同组织、细胞、细胞器中,蛋白的表达丰度差异很大,传统的CO-IP等实验很难发现低丰度蛋白的互作现象,人类蛋白组芯片上的蛋白是酵母纯化表达的蛋白,可以保证每种蛋白的丰度,芯片实验容易发现潜在蛋白互作现象。
4. 利用人类蛋白组芯片实验筛选互作蛋白,从蛋白质层面分析互作数据,避免了CO-IP后质谱鉴定时,从多肽水平跨层分析互作蛋白的不确定性和复杂性。
5. 相比酵母双杂交实验,蛋白芯片实验周期短、假阳性率低,方便复杂实验设计,可以设计多种实验对照,更能确保互作蛋白数据的准确性。

地址:上海市闵行区绿洲环路396弄5幢4层
电话:400-869-2936,021-33968791
邮箱:support@wayenbiotech.com
传真:021-33938792
QQ:2120485725
战略合作
战略合作
| Full Moon | RayBiotech | CDI | IZON | Bio-Rad | R&D Systems | IsoPlexis | Akoya | 南模生物 | 欧易生物 | 上海实验动物研究中心 | 美吉生物 | 麦特绘谱 |
特别说明:本网所有网页均为华盈生物原创信息,转载必须征求华盈生物同意,并同时注明本网名称及网址。
专利代码