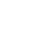细胞膜蛋白:包括GPCR、离子通道等蛋白,是大分子抗体药物和小分子药物设计针对的主要靶点。尤其是目前主流的免疫抑制剂类单抗药物,CAR-T等细胞治疗的Car等,均主要围绕如CD19、CTLA4、PD1等经典的细胞膜蛋白药靶展开设计。然而,细胞膜蛋白一般结构很复杂,具有多次跨膜结构。普通的膜蛋白表达纯化技术获得的膜蛋白很难保持构象正确,保持生物活性。MPA细胞膜蛋白芯片技术,通过独特的技术设计,不仅解决了细胞膜蛋白构象与活性问题,还可以进行高通量的细胞膜结合筛选工作,是膜蛋白研究的重要技术工具。
| 细胞膜蛋白芯片介绍
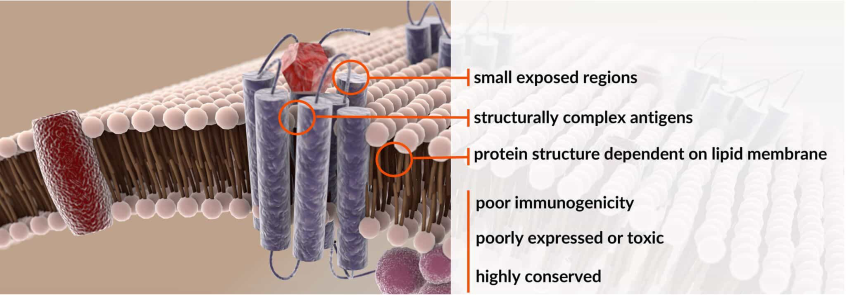
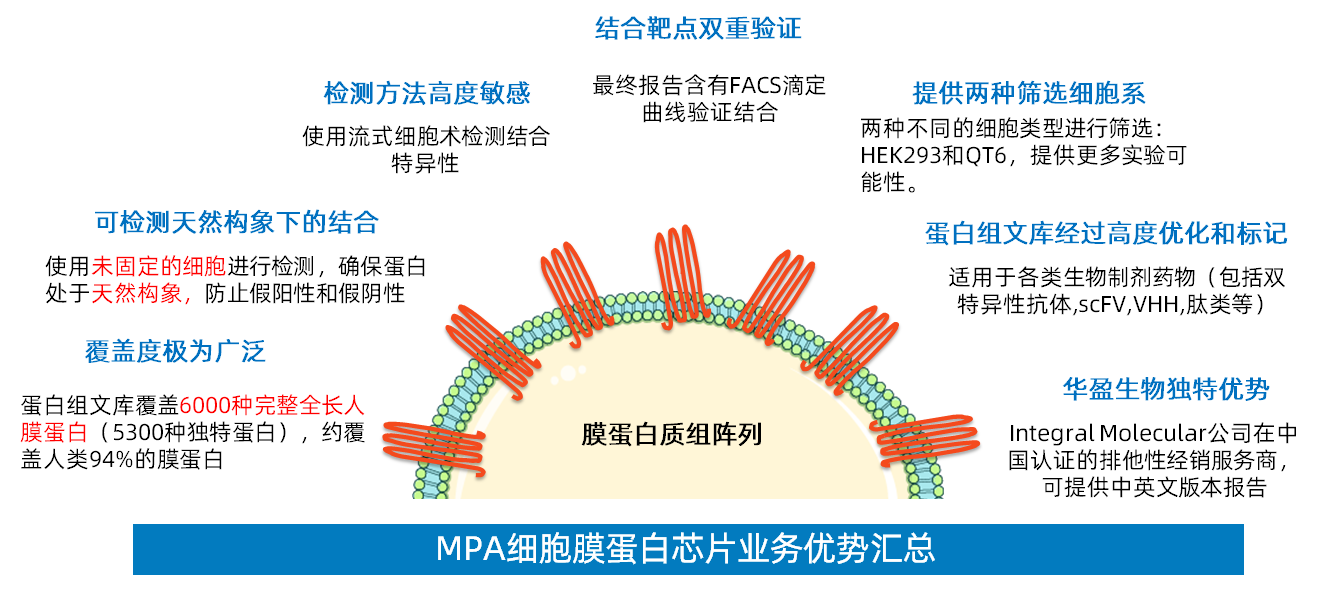
MPA细胞膜蛋白芯片技术,是由美国Integral Molecular公司现任CEO Ben Doranz博士等6名资深专家,经过20年的技术和资源积累,创造性地将5300余种膜蛋白(涵盖了人类94%的膜蛋白,包含所有的蛋白质类别,例如单次跨膜、多次跨膜和GPI锚定蛋白)表达于384孔板培养的活的人类细胞膜表面,形成的细胞膜蛋白微阵列技术,即膜蛋白质组芯片(Membrane Proteome Array,MPA)技术。将膜蛋白表达于细胞膜的表面,由于有磷脂双分子层的立体支撑,膜蛋白就能够保持正确的空间构象和生物学活性。而这些膜蛋白正是大分子抗体药物等的主要作用靶点,或毒副作用的靶点。
| 应用方向
● IND申报前单抗药物特异性鉴定
● 抗体工程化改造评估
● CAR-T/CAR-NK优化设计
● 疫苗安全生产
● 小分子靶点与脱靶确认
● 孤儿蛋白配体识别
● 新蛋白药靶发现
| 技术路线
MPA细胞膜蛋白芯片技术的实验流程分为三个阶段:第一阶段,客户需提供单抗药物的目标靶点,实验平台会根据经验将抗体分为4个浓度与表达有膜蛋白的细胞进行孵育,利用高通量免疫荧光流式检测抗体与目标蛋白的结合情况,以筛选第二阶段正式实验最佳上样浓度,并确定阴性对照的假阳性率。第二阶段,将抗体采用第一阶段选定的最佳浓度与384孔板中的细胞进行孵育,利用高通量免疫荧光流式检测抗体与哪些孔中的细胞产生结合信号,通过独特的交叉孔排列组合验证的方式进行假阳性结合信号的排除,获取阳性结合蛋白列表。第三阶段,对细胞膜蛋白芯片筛选出的结合蛋白,采用一对一验证的方式再次确认阳性结合。验证通过标准:被验证的靶点与抗体结合能够呈现浓度梯度关系,并且最高的两个浓度的MFI荧光值 至少超过背景的 2 倍以上。以上严密的实验设计结合丰富的实验对照,既达到了获得高检测灵敏度的要求,又排除了假阳性结果的干扰。
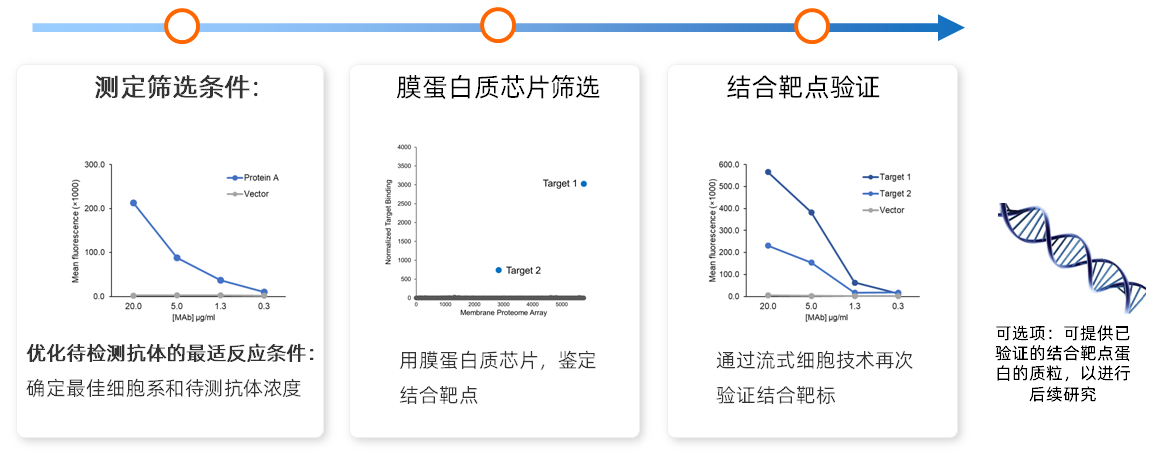
| 技术优势
由于MPA膜蛋白质组芯片技术完美解决了膜蛋白筛选和鉴定的诸多难题,一经推出,便在抗体研究领域引发了强烈反响,迅速成为单抗药物靶点特异性鉴定的金标准技术,受到国内外IND评审专家的一致推荐。截止目前,Integral Molecular公司先后已经为超过400家医药企业和科研院所,推进过2000+单抗药物研究项目。在Nature、Cell、Science等顶级期刊发表的文献已经超过350+篇。
| 服务资质
美国Integral Molecular公司于2021年3月1日起,正式授权华盈生物为Integral Molecular公司在中国特约经销服务商(Exclusive Collaboration Relationship),以作为Integral Molecular公司MPA膜蛋白质组芯片业务全球战略的重要一环。有了华盈生物的参与,Integral Molecular公司不仅能够在中国大陆市场获得更加广阔的市场预期。更重要的是,通过华盈生物自身蛋白芯片技术服务团队在MPA整个服务流程上的专业管控,中国国内的单抗药物研发团队将能够获得与美国同行同等品质和便捷的膜蛋白芯片服务,从而进一步提升Integral Molecular公司MPA膜蛋白质组芯片业务在中国市场的口碑。
有了MPA膜蛋白质组芯片业务的帮助,相信中国的单抗药物研发团队的研发和IND申报速度将会得到质的提升。同时,MPA也将会大大减少单抗药物在研发和临床实验中不必要的浪费,从而为加速中国抗体药物的研发进展,占领抗体药物市场的桥头堡作出贡献。

| 相关文献
[1]. Oh S, Mao X, Manfredo-Vieira S, et al. Precision targeting of autoantigen-specific B cells in muscle-specific tyrosine kinase myasthenia gravis with chimeric autoantibody receptor T cells. Nat Biotechnol. 2023 Jan 19:10.1038/s41587-022-01637-z.(宾夕法尼亚大学佩雷尔曼医学院)IF=46.9
[2]. Wood Chase A P, Zhang Jinru, Aydin Deniz, et al. Structure and mechanism of blood-brain-barrier lipid transporter MFSD2A. Nature, 2021, 596: 444-448.(斯坦福大学医学院)IF=64.8
[3]. Suryadevara Naveenchandra, Shrihari Swathi, Gilchuk Pavlo, et al. Neutralizing and protective human monoclonal antibodies recognizing the N-terminal domain of the SARS-CoV-2 spike protein. Cell, 2021, 184: 2316-2331.e15.(范德比尔特大学医学中心)IF=64.5
[4]. Chen Fang, Tzarum Netanel, Lin Xiaohe, et al. Functional convergence of a germline-encoded neutralizing antibody response in rhesus macaques immunized with HCV envelope glycoproteins. Immunity, 2021, 54: 781-796.e4.(斯克里普斯研究所)IF=32.4
[5]. Williamson Lauren E,Reeder Kristen M,Bailey Kevin et al. Therapeutic alphavirus cross-reactive E1 human antibodies inhibit viral egress. Cell, 2021, 184: 4430-4446.e22.(范德比尔特大学病理学、微生物学和免疫学系)IF=64.5
[6]. Arthur S. Kim, Natasha M,. Kafai, Emma S. Winkler, et al. Pan-protective anti-alphavirus human antibodies target a conserved E1 protein epitope. Cell, 2021, 184: 4430-4446.e22.4414-4429. e19.(华盛顿大学医学院)IF=64.5
[7]. Dodd Roger, Schofield Darren J, Wilkinson Trevor, et al. Generating therapeutic monoclonal antibodies to complex multi-spanning membrane targets: Overcoming the antigen challenge and enabling discovery strategies. Methods, 2020, 180: 111-126.(美国阿斯利康公司研发部)
[8]. Tucker David F, Sullivan Jonathan T, Mattia Kimberly-Anne, et al. Isolation of state-dependent monoclonal antibodies against the 12-transmembrane domain glucose transporter 4 using virus-like particles. Proc Natl Acad Sci U S A, 2018, 115: E4990-E4999.(加州大学)IF=11.1