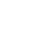新闻资讯
在临床工作中,器官移植后的免疫监测,对早期发现和诊断排斥反应,及时采取防治措施具有重要指导意义。然而,开发精准的移植监测手段仍然具有挑战性。外泌体作为一种非侵入性诊断工具很容易在生物体液中检测到,并且含有反映病理生理条件的特定核酸、蛋白质和脂质,可作为多种疾病的诊断生物标志物,其在移植后的排斥反应的监测上同样拥有巨大的潜力。今天华盈视角分享了5篇外泌体在移植监测中的应用的案例,希望能为大家的研究提供新的思路。
| 外泌体与心脏移植
2020年,J Heart Lung Transplant杂志(IF:10.247)[1]发表文章“Circulating extracellular vesicles as non-invasive biomarker of rejection in heart transplant”发现血浆循环细胞外囊泡(EVs, Extracellular Vesicle)表面蛋白谱可作为心脏移植排斥反应的非侵入性生物标志物。
该研究招募了90名患者(53个训练队列,37个验证队列),收集血浆,通过超速离心法分离外囊泡,纳米粒径分析(NTA,Nanoparticle Tracking Analysis)评估EVs浓度,多重流式细胞术测定外泌体表面抗原。结果显示,与阴性患者(RO, rejection 0)相比,排斥反应患者(ACR, Acute Cellular Rejection; AMR, Antibody-Mediated Rejection)的EVs浓度显著增加,直径减小,且急性细胞排斥患者(AMR)的EVs浓度相较于抗体介导的排斥(ACR)显著增加(图1A)。在EVs表面蛋白中,CD3、CD2、ROR1、SSEA-4、HLA-I和CD41可区分RO和AMR,而HLA-II、CD326、CD19、CD25、 CD20、ROR1、SSEA-4、HLA-I和CD41b可区分RO与ACR(图1B)。通过ROC分析证实了每个单一标志物诊断ACM(图1C)和AMR(图1D)的可靠诊断性能(曲线范围下的面积,0.727-0.939)。随后,根据差异EVs蛋白表达在建立了诊断模型,该模型能够区分接受排斥的患者和没有排斥的患者,在一个独立的外部队列中验证的准确度达到了86.5%(图1E)。总体结果表明,循环EVs作为表征心脏同种异体移植排斥反应的新工具非常有前景。
| 外泌体与肾移植
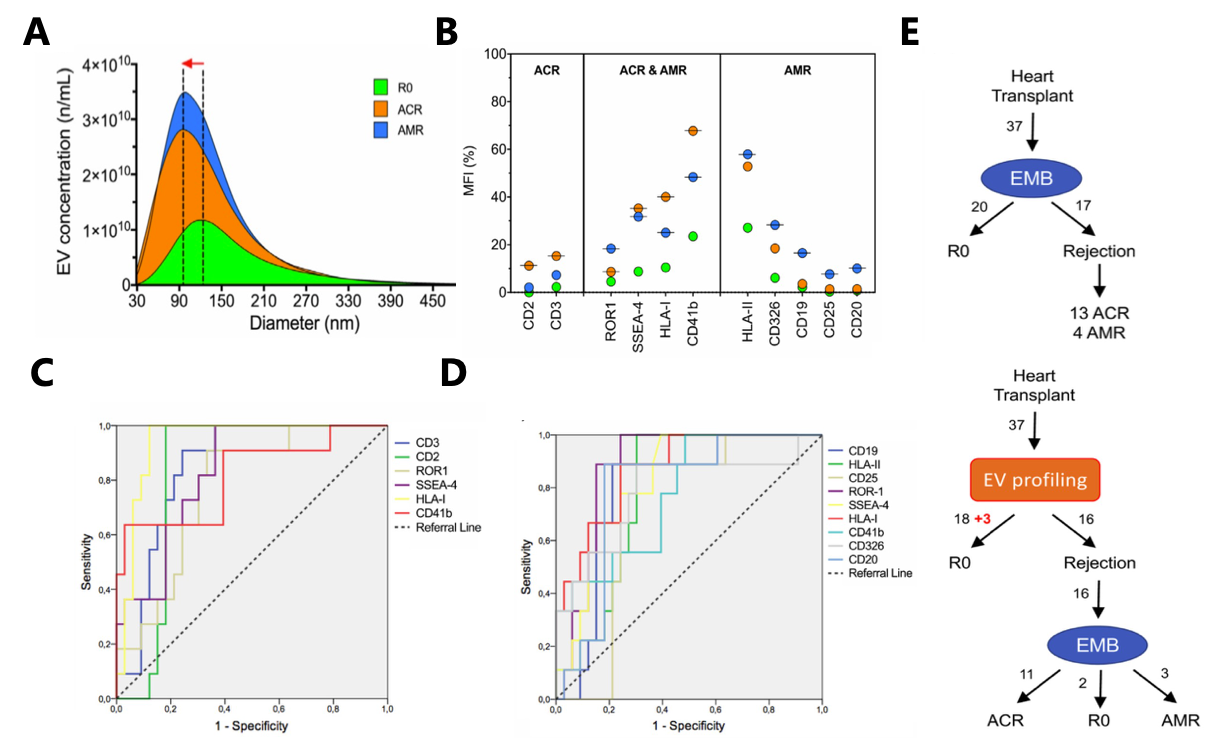
2021年,J Am Soc Nephrol杂志(IF:10.122)[2]发表文章“Discovery and Validation of a Urinary Exosome mRNA Signature for the Diagnosis of Human Kidney Transplant Rejection”发现从尿液中分离出的外泌体可能是肾移植排斥反应的可行生物标志物。
该研究从175名肾移植活检的患者中采集了220份尿液样本(图2A),通过试剂盒方法分离出尿液外泌体,随后从这些囊泡中分离出RNA,采用基因芯片(TaqMan OpenArray Human Inflammation Panel)的方法,并确定了15个基因组成的Panel可以区分排斥反应是否发生,ROC分析显示AUC为0.93(95% CI,0.87 至 0.98)。基于外泌体的特征的阴性预测值为93.3%,阳性预测值为86.2%(图2B)。此外,该研究还确定了5个基因组成的panel可以将T细胞介导的排斥患者(TCMR, T cell–mediated rejection)与抗体介导的排斥患者(ABMR, antibody- mediated rejection)区分开来(AUC为 0.87;95% CI,0.76至0.97)。该特征的阴性预测值为90.6%,阳性预测值为77.8%(图2C)。尿液外泌体基因特征在区分TCMR和ABMR状态方面的强大表现,可以通过排除ABMR来帮助完善诊断(图2D)。总之,来自尿外泌体的mRNA特征代表了一种强大的非侵入性工具,用于筛查肾移植排斥反应。
| 外泌体与胰岛移植
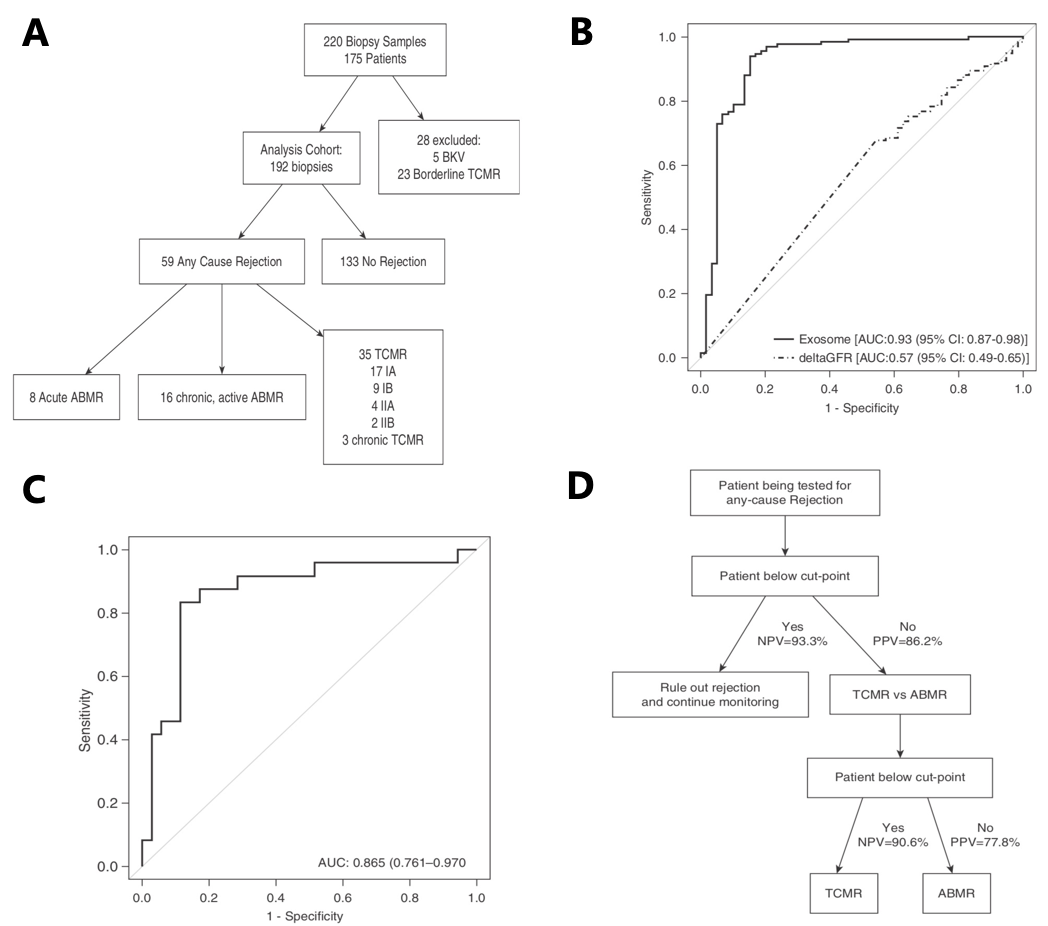
2017年,J Clin Invest杂志(IF:14.800)[3]发表文章“Tissue-specific exosome biomarkers for noninvasively monitoring immunologic rejection of transplanted tissue”发现组织特异性外泌体生物标志物可监测胰岛移植后的免疫排斥反应。
该研究利用无胸腺的糖尿病小鼠移植人的胰岛的异种移植模型进行实验,发现接种白细胞诱导免疫排斥的胰岛移植组(R-xeno)血浆中外泌体的浓度与未诱导免疫排斥的胰岛移植组(N-xeno)无统计学差异(图3A),但是R-xeno组的血浆中HLA阳性的外泌体浓度较N-xeno组明显降低(图3B)。在接种同源白细胞诱导免疫反应后,HLA阳性外泌体信号明显下降,7天后空腹血糖急剧上升(图3C)。使用抗HLA抗体偶联的磁珠从受体血浆中纯化移植的胰岛来源的外泌体,发现免疫排斥导致胰岛外泌体中内分泌激素胰岛素的下降(图3D)。随后,通过对纯化的移植胰岛源外泌体(TISEs)与移植的胰岛组织进行的蛋白质和miRNA成分分析,筛选出了部分差异表达的miRNAs(图3E),同时发现免疫排斥反应会导致TISE蛋白的改变(图3F)。最后,通过收集临床样本发现出现免疫排斥的患者HLA外泌体信号在约100天后一直在下降,血糖在800-1000天时急剧上升(图3G)。此外,TISE成分可以在临床样本中纯化并检测到,且供体外泌体的血浆分析显示在产生免疫排斥反应后HLA-A2信号是阴性的(图3H)。总之,该研究结果表明移植组织将供体特异性HLA外泌体释放到受体循环中,并且供体外泌体成分的定量和分析或可作为监测排斥反应的生物标志物。
| 外泌体与肺移植
2021年,Transplantation杂志(IF:4.934)[4]发表文章“Circulating Donor Lung-Specific Exosome Profiles Enable Noninvasive Monitoring of Acute Rejection in a Rodent Orthotopic Lung Transplantation Model”发现循环供体肺特异性外泌体特征能够在啮齿动物原位肺移植模式下对急性排斥进行无创监测。
该研究将表达人类CD63-GFP的Wistar转基因大鼠的左肺移植到MHC错配的Lewis大鼠或同源对照中,在移植后4小时至10天之间收集受体大鼠血浆,并通过尺寸排阻柱层析分离外泌体,通过纳米流式对循环供体外泌体进行分析,发现急性同种异体移植排斥对受体大鼠外周血循环中的外泌体总量没有影响(图4A),循环供体特异性外泌体谱预示着组织病理学移植物损伤前的早期急性排斥反应,发生移植排斥的受体大鼠的血浆中供体外泌体信号在第1天达到峰值,但在第2天显着下降,到第3天,在组织病理学出现排斥反应之前,供体肺特异性hCD63外泌体信号降低至移植前基线值(图4B)。在发生排斥的情况下,在移植后4小时,通过蛋白质印迹显示hCD63和GFP的富集的外泌体CD63高表达,但在移植后3天检测不到信号(图4C)。采用纳米颗粒流式细胞术量化循环供体肺外泌体发现,在排斥组中,移植后4小时和1天供体肺特异性外泌体增加,但信号在移植后第3天恢复到移植前基线(图4D)。在非排斥组中,FACS检测在受体中显示出稳态供体外泌体信号(图4E)。总之,循环供体肺特异性外泌体特征能够在肺同种异体移植物损伤的组织学表现之前及早发现急性排斥反应。

| 外泌体与细胞移植
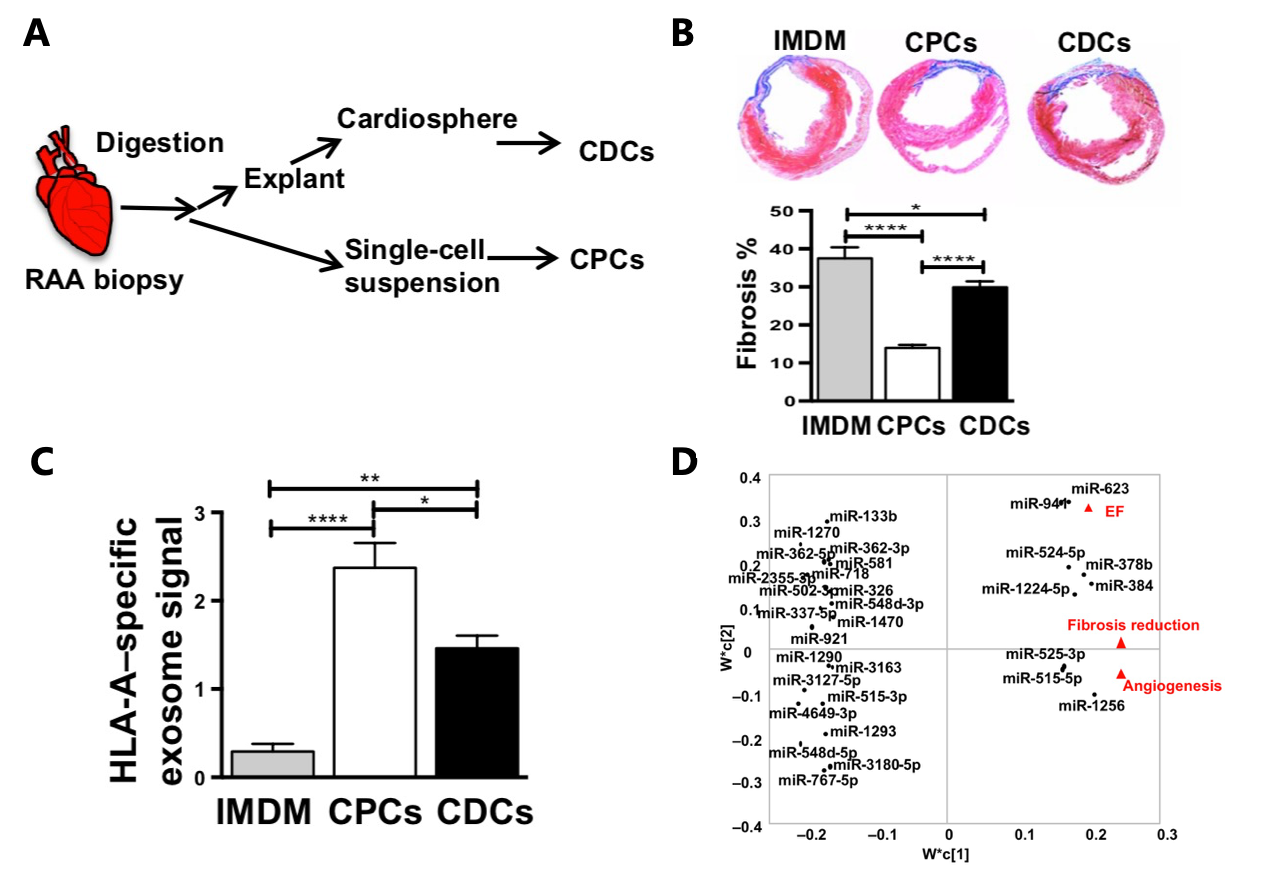
2019年,Science Translational Medicine杂志(IF:17.956)[5]发表文章“Circulating exosomes derived from transplanted progenitor cells aid the functional recovery of ischemic myocardium”发现受体血浆中定量和表征移植细胞衍生的外泌体将能够对移植细胞的活性进行可靠的、非侵入性的监测。
研究人员使用了一种人-大鼠异种心肌梗死模型,比较了两种研究较多的祖细胞类型:心肌来源细胞(CDCs)和c-kit+心脏祖细胞(CPC)(图5A),发现在体内再生能力测定中,CPC表现优于CDC(图5B)。为了在体内非侵入性地监测移植的CDC或CPC的活性,研究人员采用尺寸排阻的方法从受体总血浆中纯化了祖细胞特异性外泌体,并发现移植后7天,与CDC特异性外泌体相比,血浆CPC特异性外泌体的浓度增加约两倍(图5C)。生物信息学的通路分析未能将CPC或CDC细胞mRNA与观察到的心肌修复联系起来,但与受体血浆中纯化的CPC外泌体的miRNA有关(图5D)。总之,该研究研究了CDC和CPC的心脏修复潜力,验证了干/祖细胞特异性外泌体的监测潜力,并证明外泌体miRNA反映了移植干细胞的功能性心肌修复,这些发现证明了循环中祖细胞特异性外泌体作为液体活检的潜力,其为移植细胞的状态提供了非侵入性监测的方案。
| 华盈视角
上述的5个研究案例我们可以看到,外泌体在移植监测方面拥有巨大的应用前景。华盈视角小编通过对移植相关的文献的整理,精选了上述5篇为大家进行了解析,同时,我们也给在移植监测这一块感兴趣的科研工作者提供了一些建议:
1、外泌体在移植监测这一块目前的研究相对较少,对于很多移植科的医生来说是一个非常好的机会,外泌体在肾移植、肺移植、肝移植、心脏移植,胰岛移植,以及细胞移植等方面仍有很大的挖掘空间,无论是标志物研究还是机制研究,均有很好的突破点。
2、外泌体中含有特定核酸、蛋白质和脂质,均可作为我们研究的标志物分子或功能分子,我们可以通过蛋白质组学、转录组学、抗体芯片、代谢组学等高通量的筛选方法来确定差异表达的分子作为我们的研究对象,用于移植后的排斥监测。
3、外泌体的提取对于外泌体的后续分析至关重要,我们可以看到文献一和二分别采用了超速离心法和试剂盒的方法,文献三、四、五均采用了尺寸排阻的方法。而尺寸排阻法相对来说可以分离出更高纯度和活性的外泌体。
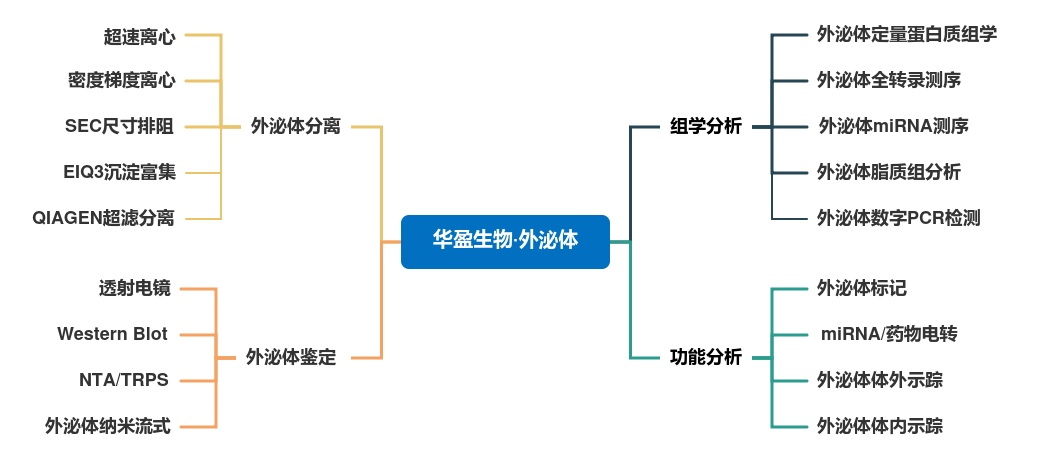
| 华盈生物-外泌体研究服务
华盈生物作为外泌体服务领域的专家,拥有独特的系统性服务优势,可实现外泌体研究的“一站式服务”。经过近10年的稳步发展,华盈生物的外泌体服务产品也已扩展到了外泌体研究的方方面面,包括但不限于:外泌体的三项鉴定(电镜、WB、NTA)、外泌体蛋白组筛选(lable free、DIA、PRM、MRM)、外泌体核酸筛选(miRNA、RNA全转录组)、外泌体纳米流式检测、外泌体电转(药物分子、核酸)、外泌体细胞&动物功能实验(PKH26/DiR/量子点、荧光示踪)等等。
丰富全面的外泌体功能研究手段尽在华盈生物的武器库(下图标红色为华盈生物特色服务),快来一探究竟,有华盈助力,加速你的外泌体项目研究!
| 相关文献
[1]. Castellani C, Burrello J,Fedrigo M, et al. Circulating extracellular vesicles as non-invasive biomarker of rejection in heart transplant. [J]. The Journal of Heart and Lung Transplantation, 2020 Oct;39(10):1136-1148.
[2]. Fekih R E, Hurley J, Tadigotla V, et al. Discovery and Validation of a Urinary Exosome mRNA Signature for the Diagnosis of Human Kidney Transplant Rejection. [J]. Journal of the American Society of Nephrology, 2021: ASN.2020060850.
[3]. Vallabhajosyula P, Korutla L, Habertheuer A, et al. Tissue-specific exosome biomarkers for noninvasively monitoring immunologic rejection of transplanted tissue.[J]. Journal of Clinical Investigation, 2017, 127(4):1375-1391.
[4]. Andreas Habertheuer, Chirag Ram, et al. Circulating Donor Lung-Specific Exosome Profiles Enable Noninvasive Monitoring of Acute Rejection in a Rodent Orthotopic Lung Transplantation Model. [J]. Transplantation. 2021 May 14.
[5]. Saha P, Sharma S,Korutla L,et al. Circulating exosomes derived from transplanted progenitor cells aid the functional recovery of ischemic myocardium.[J].Science Translational Medicine, 2019, 11(493):eaau1168.
了解更多华盈视角解读,欢迎关注“华盈生物”公众号

地址:上海市闵行区绿洲环路396弄5幢4层
电话:400-869-2936,021-33968791
邮箱:support@wayenbiotech.com
传真:021-33938792
QQ:2120485725
战略合作
战略合作
| Full Moon | RayBiotech | CDI | IZON | Bio-Rad | R&D Systems | IsoPlexis | Akoya | 南模生物 | 欧易生物 | 上海实验动物研究中心 | 美吉生物 | 麦特绘谱 |
特别说明:本网所有网页均为华盈生物原创信息,转载必须征求华盈生物同意,并同时注明本网名称及网址。
专利代码