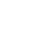新闻资讯
PNAS | 单细胞测序如何提升外泌体机制研究的临床应用价值
- 分类:华盈视角
- 作者:华盈生物
- 来源:
【概要描述】近期PNAS发表的一篇文章指出了肿瘤细胞来源的外泌体可以刺激单核细胞的分化,并且展现出的细胞表型不同于细胞因子刺激后的表型。肿瘤细胞来源的外泌体会诱导单核细胞特征性基因的表达,这些基因表达信号被称作外泌体特异性信号,并且与病人预后显著相关[1]。今天华盈生物就为大家解读这篇极富创新元素的研究,包括外泌体和非外泌体组分如何对比研究、体外数据如何和临产样本数据联合分析、单细胞和外泌体如何整合分析。
PNAS | 单细胞测序如何提升外泌体机制研究的临床应用价值
【概要描述】近期PNAS发表的一篇文章指出了肿瘤细胞来源的外泌体可以刺激单核细胞的分化,并且展现出的细胞表型不同于细胞因子刺激后的表型。肿瘤细胞来源的外泌体会诱导单核细胞特征性基因的表达,这些基因表达信号被称作外泌体特异性信号,并且与病人预后显著相关[1]。今天华盈生物就为大家解读这篇极富创新元素的研究,包括外泌体和非外泌体组分如何对比研究、体外数据如何和临产样本数据联合分析、单细胞和外泌体如何整合分析。
- 分类:华盈视角
- 作者:华盈生物
- 来源:
- 发布时间:2022-07-06 15:32
- 访问量:
肿瘤相关巨噬细胞(Tumor-associated macrophages, TAMs)可以促进肿瘤细胞的侵袭和转移,是肿瘤微环境的重要的免疫细胞。循环的单核细胞被征募到肿瘤组织,在这里分化成TAMs。但是单核细胞的命运与肿瘤微环境密切相关,特别是肿瘤细胞来源的信号会直接影响单核细胞的分化途径,造成TAMs的异质性。已经被广泛研究的是肿瘤细胞分泌的细胞因子、趋化因子等对TAMs分化的作用。随着外泌体在肿瘤微环境中的重要作用被越来越多的研究所揭示,那么肿瘤细胞来源的外泌体是否也会影响TAMs的分化?
近期PNAS发表的一篇文章指出了肿瘤细胞来源的外泌体可以刺激单核细胞的分化,并且展现出的细胞表型不同于细胞因子刺激后的表型。肿瘤细胞来源的外泌体会诱导单核细胞特征性基因的表达,这些基因表达信号被称作外泌体特异性信号,并且与病人预后显著相关[1]。今天华盈生物就为大家解读这篇极富创新元素的研究,包括外泌体和非外泌体组分如何对比研究、体外数据如何和临产样本数据联合分析、单细胞和外泌体如何整合分析。

| 01、外泌体和其他分泌组分的有效分离
研究者利用尺寸排阻分离了三阴乳腺癌(triple negative breast cancer cell, TNBC)细胞系MDA-MB-231细胞上清的外泌体(图1A)。结果可以很明显的将外泌体组分和其他可溶性蛋白组分分离开(图1B),通过WB检测外泌体marker和电镜分析囊泡结构进行了验证(图1C)。最后收集浓缩了外泌体富集组分(F7-F10),命名为EV-R(EV-rich)和非外泌体组分(F15-F22),名为EV-P(EV-poor)进行后续实验。
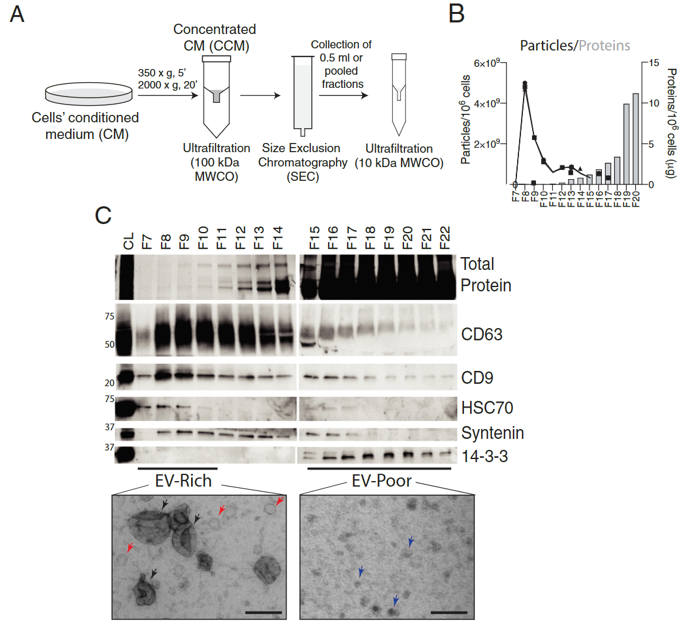
图1 尺寸排阻法分离和富集外泌体和其他可溶性蛋白
| 02、MDA-MB-231细胞来源的外泌体和可溶性组分诱导单核细胞向巨噬细胞分化
研究者分选了健康提供者PBMC中CD14+单核细胞体外培养,然后用EV-R和EV-P分别处理,同时和两个重要的集落形成刺激因子CSF-1和GM-CSF处理做对比(图2A)。和不处理的相比,CD14+的单核细胞处理5天之后活细胞数目都显著的增加(2A)。通过形态学和流式检测各种表面marker,确定了处理后的细胞大多是巨噬细胞(图2B)。但是各种marker的表达程度在不同处理组各不相同,说明单核细胞在不同处理特别是EV-R和EV-P刺激后,会展现不同的巨噬细胞表型(图2B)。研究者着重分析了肿瘤相关巨噬细胞(TAMs)高表达的CD206 和CD163阳性的细胞表型,结果发现了EV-R处理和CSF-1处理结果相似,而EV-P处理和GM-CSF处理结果相似(图2C)。更加说明了EV-R和EV-P诱导不同的巨噬细胞表型,同时也说明了EV-R和CSF-1间存在某种关联。
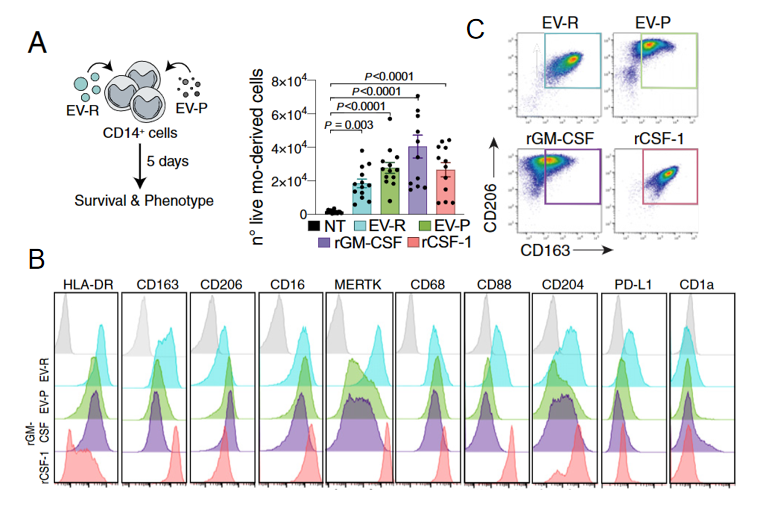
图2 外泌体和可溶性组分诱导单核细胞向巨噬细胞分化
| 03、MDA-MB-231细胞来源的外泌体通过携带的CSF-1诱导巨噬细胞分化
EV-R和CSF-1有着相似的作用效果,或许是因为CSF-1可以被外泌体携带发挥作用。为了证明外泌体携带CSF-1,研究者首先通过流式细胞术检测了尺寸排阻收集的不同组分中几个重要的因子,发现了只有CSF-1可以在EV-R中检测到(图3A),说明了CSF-1或许也存在于外泌体中;其次通过CD9、CD63和CD81抗体富集了EV-R中这些阳性的外泌体,发现了大约40%的这些特征性marker表达的外泌体也表达CSF-1(图3B);之后通过成像流式技术也发现了大约40%的CD81+ 外泌体也表达CSF-1(图3C)。研究者通过几种不同方式验证外泌体CSF-1的功能:
(1)因为CSF-1通过受体CD115发挥作用,研究者用CD115抗体预习处理培养的单核细胞,然后用EV-R处理,结果发现了CD115抗体处理会减弱EV-R诱导CD206 +CD163+巨噬细胞数目增加的效果(图3D);
(2)研究者在MDA-MB-231细胞中敲除了CSF-1基因(图3E),来源于CSF-1缺失细胞的EV-R诱导CD206 +CD163+巨噬细胞数目增加的效果明显减弱;
(3)对比分析其他低表达CSF-1的乳腺癌细胞系。研究者通过Cancer Cell Line Encyclopedia (CCLE)数据库发现了MCF-7细胞低表达CSF-1,其来源的EV-R中同样CSF-1表达相对MDA-MB-231细胞来源的表达很低(图3G),处理单核细胞其诱导CD206 +CD163+巨噬细胞分化的能力明显减弱;
(4)在MCF-7中过表达CSF-1基因,其来源的EV-R对CD206 +CD163+巨噬细胞诱导分化的能力明显增加。
通过这些方法,最终可以确定外泌体对巨噬细胞诱导分化的作用依赖于携带的CSF-1。
图3 外泌体携带的CSF-1诱导巨噬细胞分化
| 04、EV-R诱导单核细胞特征性基因表达谱
研究者近一步分析了外泌体诱导的分子水平的变化。用CSF-1浓度一致的EV-R、EV-P、MDA-MB-231细胞上清(CCM)和CSF-1重组蛋白处理单核细胞,进行转录组测序分析。PCA分析说明四组有明显不同的分子特征(图4A)。相互比较鉴别差异蛋白进行富集分析,结果展示了EV-R诱导的基因显著性的富集到细胞因子信号通路、IFN-γ信号通路等(图4B)。特别是通过检索IFN通路基因数据库Interferome,结果发现了很多干扰素刺激基因(IFN stimulated genes, ISGs)在EV-R处理的单核细胞中显著高于其他处理组(图4C)。之后研究者进行了深入的机制研究,发现了外泌体可以携带第二信使分子cGAMP直接通过激活单核细胞的cGAS/ STING通路调控IFN-γ相关基因的表达(图4D)。这些结果说明了MDA-MB-231细胞来源的外泌体可以通过激活IFN-γ相关基因表达影响细胞分化和功能。
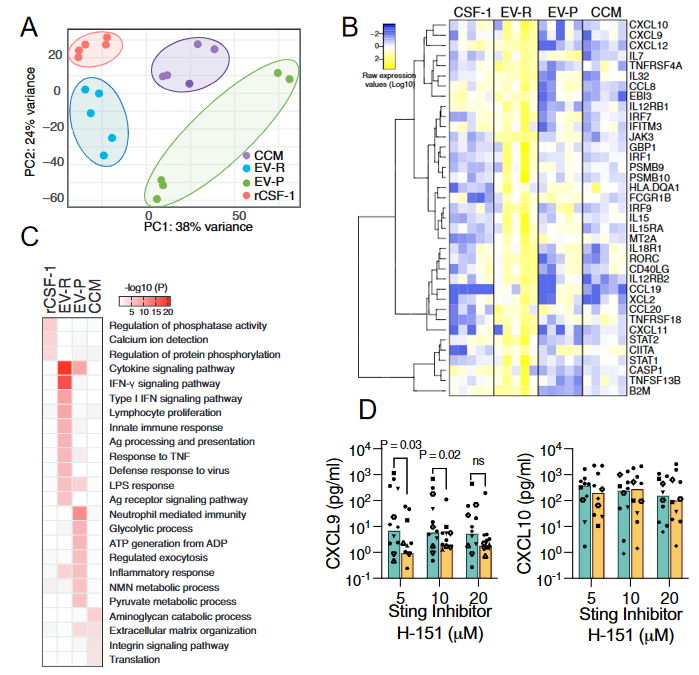
图4 不同处理的单核细胞转录组测序分析
| 05、外泌体诱导的特征性基因表达信号与患者预后显著相关
研究者最终落脚点聚焦在肿瘤细胞来源的高表达CSF-1的外泌体及其对巨噬细胞分化的作用有何临床价值上。研究者首先定义了外泌体诱导的单核细胞特征性基因信号,选取了23个高表达的基因作为EV-R特征性信号(图5A),同时也定义了EV-P特异性的信号。那么体乳腺癌细胞来源的外泌体对单核细胞的作用是否在体内真实存在,那么可以通过定义的EV-R和EV-P信号在组织单核细胞中可以体现出来。因为EV-R和EV-P诱导了不同巨噬细胞表型,因此只有只有通过单细胞测序的方式才能准确的鉴定到EV-R和EV-P信号。研究者分选了三阴乳腺癌病人肿瘤组织中HLA-DR+CD11c+单核细胞进行了单细胞转录组测序,聚焦分析单核细胞的数据。数据结果中呈现了EV-R和EV-P信号,特别是EV-R信号表达的细胞更加聚集性的成簇,单细胞测序结果表明这簇细胞属于早期分化的巨噬细胞(图5B)。这就说明了体内真实存在外泌体诱导的信号,证实了体外肿瘤细胞对单核细胞分化的作用是通过EV-R和EV-P介导的。
接着研究者分析了Molecular Taxonomy of Breast Cancer International Consortium (METABRIC) 研究队列中bulk测序结果中EV-R和EV-P信号与临床相关性。结果发现了与Luminal、HER2类型的乳腺癌相比,EV-R信号在三阴乳腺癌病人(TNBC)中显著增加,说明EV-R信号或许可以作为TNBC亚型的诊断标志物(图5C)。并且在TNBC病人数据中,只有EV-R信号与各类CD8 T细胞的信号间具有显著相关性(图5D),这也说明了表达EV-R信号的细胞与T细胞的侵润或者活性更密切。体外实验也证实了EV-R处理的单核细胞的细胞上清更能促进T细胞的迁移(图5E)。T细胞的侵润增加预示着更加有效的肿瘤细胞杀伤能力,生存分析证实了高表达EV-R信号的TNBC病人具有更高的生存率(图5F),说明EV-R信号可以作为TNBC病人的预后标志物。
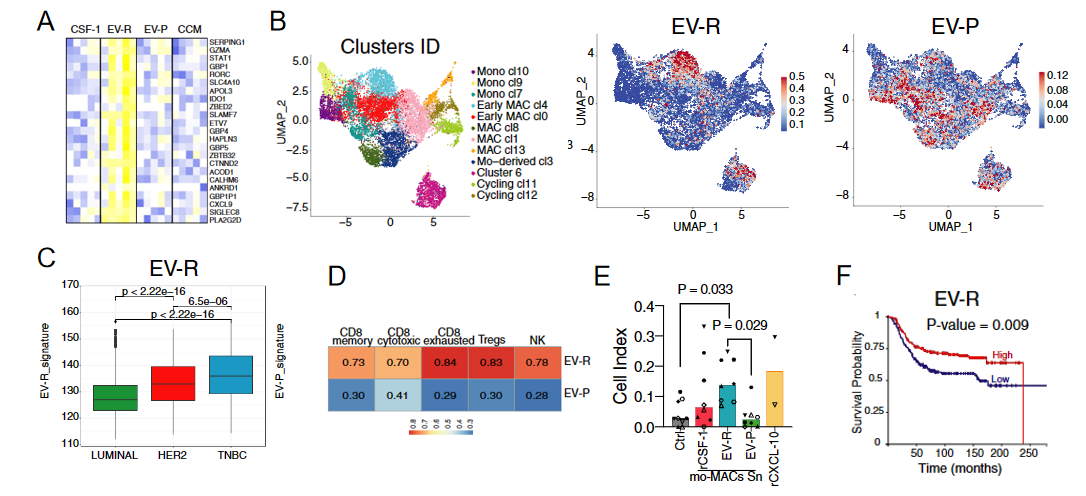
图5 外泌体诱导的单核细胞特征性基因表达与患者预后显著相关
| 总结与讨论
这篇外泌体研究案例有几个特别创新的策略。(1)肿瘤微环境有很多分泌性的因子、囊泡发挥作用,特别是来自肿瘤细胞分泌的。如何区分外泌体和其他可溶性组分是精确研究外泌体作用的关键。这篇文章就利用了现在广泛应用的尺寸排阻的分离方法。并且同时对外泌体富集的组分和其他可溶性蛋白组分进行了对比分析。这个思路可以为大家验证外泌体功能提供了一种方法,其他可溶性蛋白组分可以作为对照来同时分析。(2)另外就是单细胞测序和外泌体数据的整合分析。体外机制研究揭示的外泌体对受体细胞的重要是否在体内也存在。这篇文章利用外泌体诱导受体细胞的特征性基因为依据,通过体内单细胞测序进行了证实。这为大家之后进行的外泌体体外机制研究如何与临床意义关联起来提供一种创新的思维模式。
华盈生物——外泌体“一站式”服务平台
华盈生物作为外泌体服务领域的专家,拥有独特的系统性服务优势,可实现外泌体研究的“一站式服务”。华盈生物的外泌体服务产品也基本扩展到了外泌体研究的方方面面。在外泌体蛋白质组学方面,华盈生物不仅可以提供高品质的质谱技术服务,更是将外泌体膜蛋白检测的明星技术:纳米流式、超灵敏simoa技术、定制化抗体芯片服务整合入外泌体膜蛋白服务体系中,为外泌体膜蛋白标志物开发、外泌体膜蛋白靶向载药研究等提供技术支撑。

地址:上海市闵行区绿洲环路396弄5幢4层
电话:400-869-2936,021-33968791
邮箱:support@wayenbiotech.com
传真:021-33938792
QQ:2120485725
战略合作
战略合作
| Full Moon | RayBiotech | CDI | IZON | Bio-Rad | R&D Systems | IsoPlexis | Akoya | 南模生物 | 欧易生物 | 上海实验动物研究中心 | 美吉生物 | 麦特绘谱 |
特别说明:本网所有网页均为华盈生物原创信息,转载必须征求华盈生物同意,并同时注明本网名称及网址。
专利代码