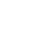新闻资讯
华盈视角:外泌体蛋白质组分析如何助力肿瘤微环境研究
- 分类:华盈视角
- 作者:华盈生物
- 来源:
【概要描述】肿瘤细胞能否在远方转移灶部位附着、生存、增殖并最终形成转移癌依赖于肿瘤细胞与转移前微环境(Pre-Metastatic Niche)之间的“交流对话”,而肿瘤细胞来源的外泌体(Tumor-Derived Exosomes)在重构转移前微环境,进而促进转移癌的形成过程中扮演着决定性的作用[1]。
华盈视角:外泌体蛋白质组分析如何助力肿瘤微环境研究
【概要描述】肿瘤细胞能否在远方转移灶部位附着、生存、增殖并最终形成转移癌依赖于肿瘤细胞与转移前微环境(Pre-Metastatic Niche)之间的“交流对话”,而肿瘤细胞来源的外泌体(Tumor-Derived Exosomes)在重构转移前微环境,进而促进转移癌的形成过程中扮演着决定性的作用[1]。
- 分类:华盈视角
- 作者:华盈生物
- 来源:
- 发布时间:2022-05-23 13:29
- 访问量:
肿瘤细胞能否在远方转移灶部位附着、生存、增殖并最终形成转移癌依赖于肿瘤细胞与转移前微环境(Pre-Metastatic Niche)之间的“交流对话”,而肿瘤细胞来源的外泌体(Tumor-Derived Exosomes)在重构转移前微环境,进而促进转移癌的形成过程中扮演着决定性的作用[1]。已有研究表明,多种肿瘤细胞来源的外泌体均可以调控转移前的微环境状态[2-5]。纽约威尔康奈尔医学院的研究人员认为,肿瘤细胞分泌的外泌体中的蛋白质(如黑色素瘤外泌体中的受体酪氨酸激酶蛋白MET,胰腺导管腺瘤外泌体中的巨噬细胞迁移抑制因子MIF以及肿瘤细胞外泌体中的整合素蛋白)是介导肿瘤细胞趋向不同器官转移的关键因素。因此,他们利用蛋白质组学技术筛选了在肿瘤脑转移中发挥核心作用的外泌体蛋白质,发现了CEMIP (Cell Migration Inducing Hyaluronidase 1),并对其进行了深入的机理挖掘,相关研究成果发表在Nat Cell Biol上[5]。让华盈视角和大家一起来欣赏这篇美文吧。
| 确定外泌体促肿瘤脑转移作用
为了研究外泌体对乳腺癌细胞在脑转移中克隆增殖的影响,研究者首先优化了小鼠脑片模型。研究者解剖分离了NCr裸鼠(Taconic)或近亲Foxn-/-雌性小鼠的的大脑进行250μm的冠状切片。在6孔板中,3个半脑切片为一组平放于0.4μm聚碳酸酯膜细胞培养插入物最顶部,孔的最底部预先加入培养液。研究者将内径为3 mm的无菌透明聚碳酸酯环放置在每个片的顶部用来建立一个界限清晰的区域进行外泌体和癌细胞的接种(图1)。
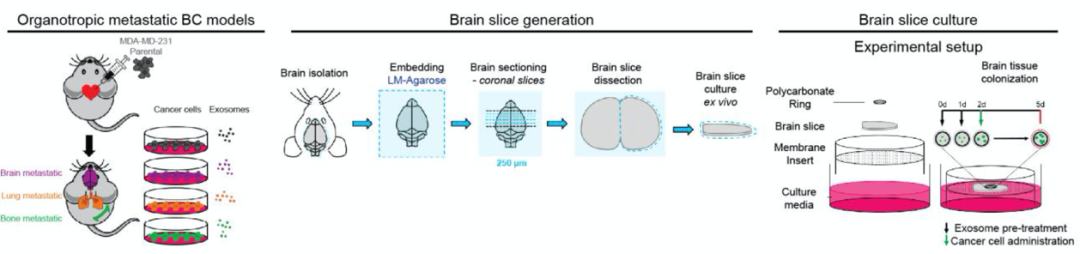
图1.小鼠脑片模型示意图
研究者比较了趋化不同器官转移的癌细胞外泌体的作用,包括乳腺癌亲代细胞:MDA-MB-231,脑转移乳腺癌细胞:231BR (brain-tropic, BrT1)和831 (brain-tropic, BrT2),肺转移乳腺癌细胞:4175 (lung-tropic, LuT1) 和4173 (lung-tropic, LuT2),骨转移乳腺癌细胞:1833 (bone-tropic, BoT1)(所有细胞都可表达GFP,便于荧光观察)。利用上述癌细胞来源的外泌体分别预处理小鼠脑片,然后加入脑转移癌细胞231 BrT1细胞培养,结果发现与PBS预处理和其他癌细胞来源的外泌体预处理组相比,231 BrT1细胞来源的外泌体预处理脑片会显著增加231 BrT1细胞数量(图2a)以及促进其对脑组织的侵袭(图2b),同样也会增加MDA-MB-231,231LuT1和1231BoT1细胞在脑片上的克隆增殖能力。这些结果说明只有具有脑转移能力的癌细胞分泌的外泌体才能促进癌细胞靶向脑部进行克隆增殖。这也预示着与其他癌细胞相比,脑转移癌细胞来源的外泌体中可能含有差异性或特异性的作用因子。
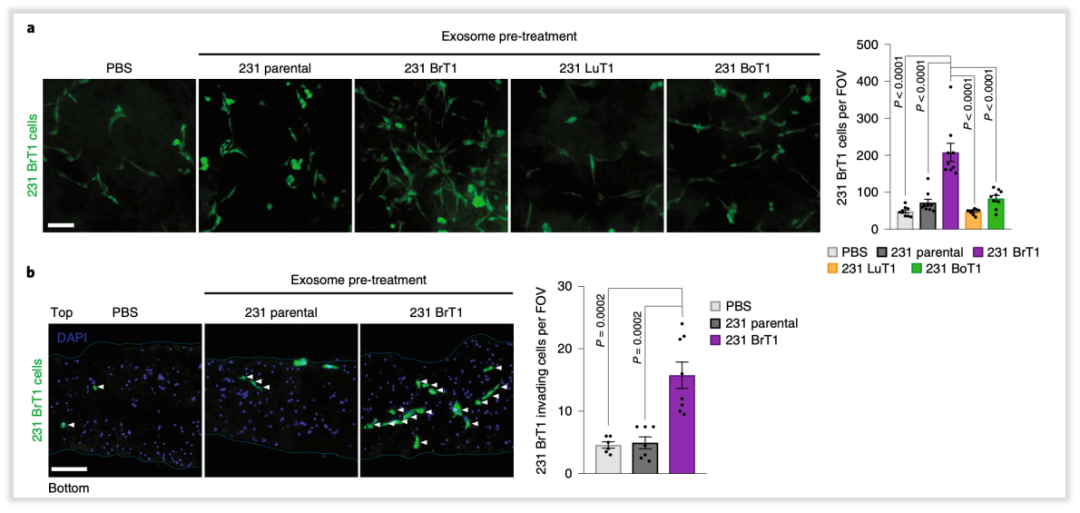
图2. 231 BrT1细胞来源的外泌体促进231 BrT1细胞
在脑片上的克隆增殖和侵袭能力
| 筛选外泌体中的特异性蛋白质
为了寻找231 BrT1细胞来源的外泌体中起关键作用的蛋白质,研究者采用了Label free LC-MS/MS技术分析比较了不同细胞系培养上清中外泌体的蛋白组成分,包含2种脑转移癌细胞(231 BrT1,231 BrT2),2种肺转移癌细胞(231 LuT1,231 LuT2),1种骨转移癌细胞231 BoT1和乳腺癌亲代细胞MDA-MB-231。结果发现相当于其他类型细胞,脑转移癌细胞来源的外泌体中有20个显著差异表达的蛋白质(图3a),其中CEMIP (Cell Migration Inducing Hyaluronidase 1)是差异最显著的蛋白质(图3a)。之后Western Bloting实验也验证了蛋白质谱的结果:CEMIP高表达在脑转移癌细胞来源的外泌体中(图3b,c)。为了更加精确的说明CEMIP特异性的高表达在外泌体中,研究者利用密度梯度离心技术分离高纯度的外泌体,发现了这些外泌体确实显著富集了CEMIP蛋白(图3d)。同样,从临床乳腺癌脑转移患者肿瘤中分选出癌细胞进行体外培养,从其上清中分离的外泌体中也检测到了高表达的CEMIP蛋白(图3e)。这些结果说明CEMIP高表达在脑转移癌细胞来源的外泌体。
图3. 脑转移癌细胞来源的外泌体高表达CEMIP蛋白质
| 体外实验证实外泌体特异性蛋白质
为了研究外泌体中CEMIP蛋白质的功能,研究者将野生型231 BrT1细胞(BrT1 WT)和敲除CEMIP的231 BrT1细胞(BrT1 CEMIP KO)接种到脑片上培养,BrT1 CEMIP KO细胞丢失了像BrT1 WT细胞那样的纺锤形外部形态,而这种纺锤形态标志着细胞附着在血管上,利用双色免疫荧光观察更加验证了BrT1 CEMIP KO细胞不能与血管共定位在一起(图4a)。另外BrT1 CEMIP KO细胞在脑片上的侵袭能力也显著下降(图4b)。然后研究者利用外泌体进行Rescue实验,结果发现只有BrT1 WT细胞来源的外泌体预处理脑片可以显著性恢复BrT1 CEMIP KO细胞和血管间的附着能力(图4c)和对脑组织的侵袭能力(图4d)。
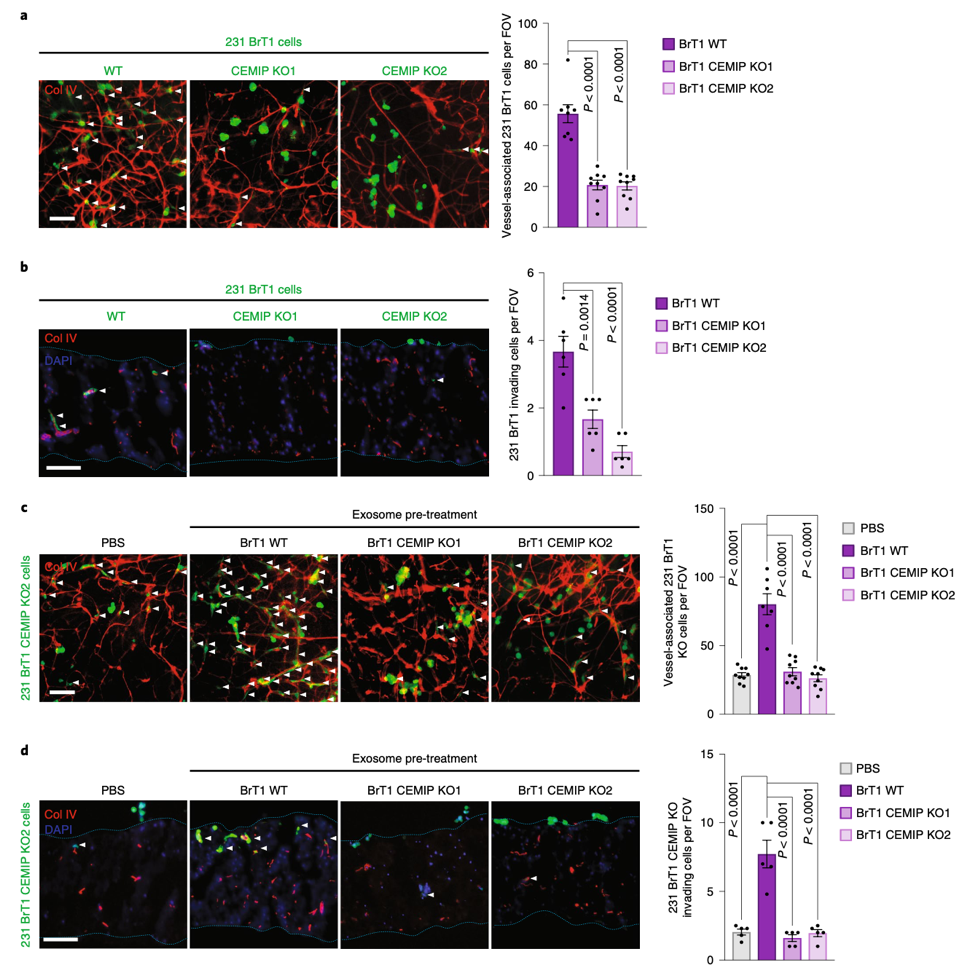
图4.体外脑片实验验证脑转移癌细胞来源的CEMIP+外泌体
可调控脑血管形成, 促癌细胞脑转移
| 体内实验证实外泌体特异性蛋白质的功能
体内实验中表明和BrT1 WT细胞注射的小鼠相比,BrT1 CEMIP KO细胞注射小鼠体内癌细胞脑转移的程度显著减少(图5a)。之后研究者用PBS,BrT1 WT和BrT1 CEMIP KO细胞来源的外泌体预先注射到小鼠体内,再注入BrT1 WT细胞,结果表明只有BrT1 WT细胞来源的外泌体处理组小鼠脑转移的癌细胞显著增加(图5b)。这些结果说明外泌体对癌细胞脑转移的增强能力依赖于CEMIP蛋白。
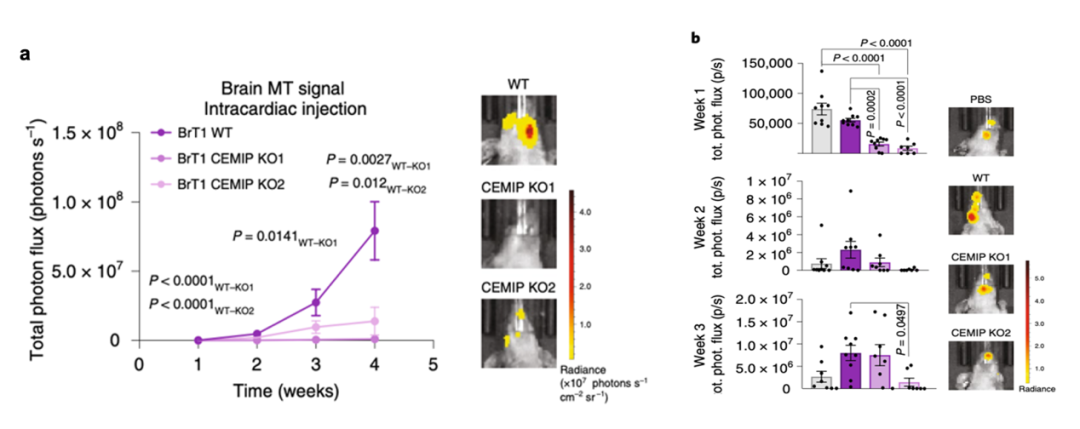
图5.体内实验验证脑转移癌细胞来源的
CEMIP+外泌体可促癌细胞脑转移
| 明确外泌体特异性蛋白质的作用机制
因为外泌体CEMIP可以影响脑血管和癌细胞的附着,之后研究者聚焦在外泌体对转移前微环境中脑血管影响的机制研究中。通过免疫荧光实验,研究者在体外和体内也验证了脑血管内皮细胞和小胶质细胞可以摄取PKH67或者PKH26标记的外泌体(图6a, b),通过体外血管生成实验发现了BrT1 WT细胞来源的外泌体,而不是BrT1 CEMIP KO细胞来源的外泌体,可以促进血管生成(图5c)。另外和野生型MDA-MB-231细胞相比,来源于过表达CEMIP的MDA-MB-231细胞的外泌体会显著促进血管生成(图6c)。这些结果说明脑转移癌细胞来源的外泌体CEMIP可以重塑脑血管网络。
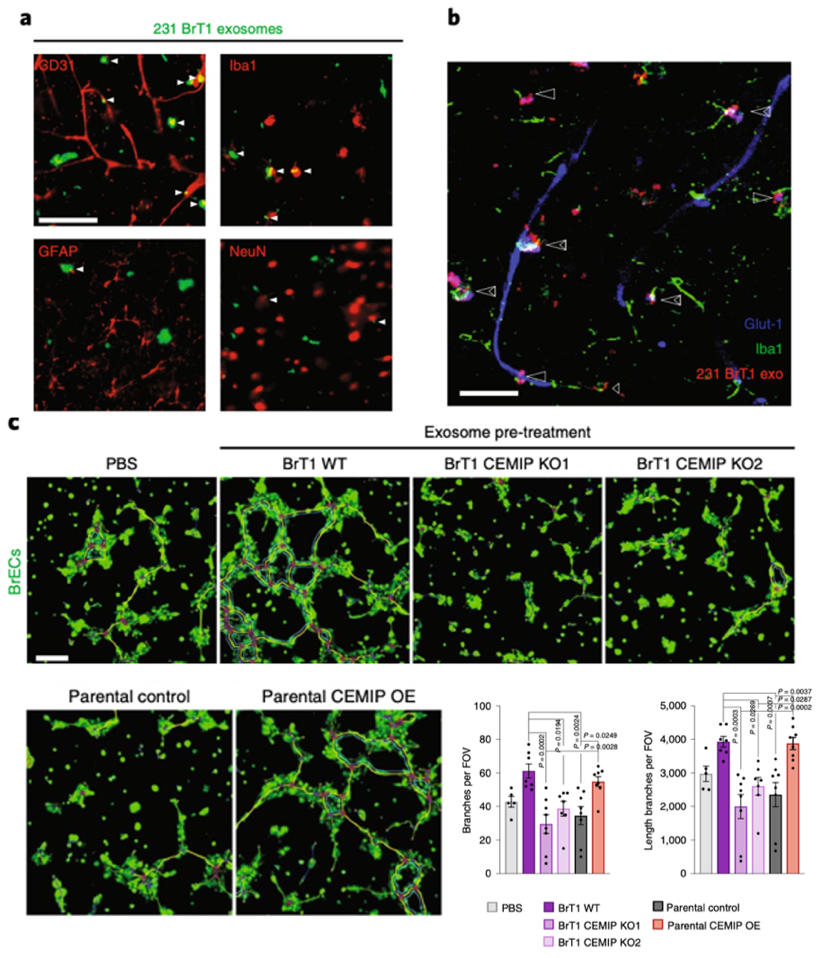
图6. CEMIP+外泌被脑内皮细胞和小胶质细胞摄入并促进血管新生
为了更近一步的揭示外泌体CEMIP影响血管重塑的分子机制,研究者利用流式细胞技术分选摄取CEMIP+外泌体和CEMIP-外泌体的内皮细胞和小胶质细胞进行转录组测序。转录组结果发现了在CEMIP+外泌体摄取的细胞中炎症和肿瘤转移相关的信号通路被激活。IPA通路分析发现,在脑内皮细胞中外泌体CEMIP可以显著性的改变参与血管形态发生和淋巴管发生的基因表达(图7a)。IPA分析还发现,CEMIP依赖型的钙离子信号改变,可能造成了下游与血管发生和重塑的基因表达,从而影响了血管表型。在小胶质细胞中外泌体CEMIP同样改变了与血管重塑的基因表达,例如细胞粘附和迁移,炎症相关因子等(图7b)。这些分析结果说明脑转移癌细胞来源的外泌体CEMIP可以通过改变内皮细胞和小胶质细胞中参与血管发生相关基因的表达,影响血管发生,重构转移前微环境中的血管网络,从而促进癌细胞脑转移和克隆增殖。
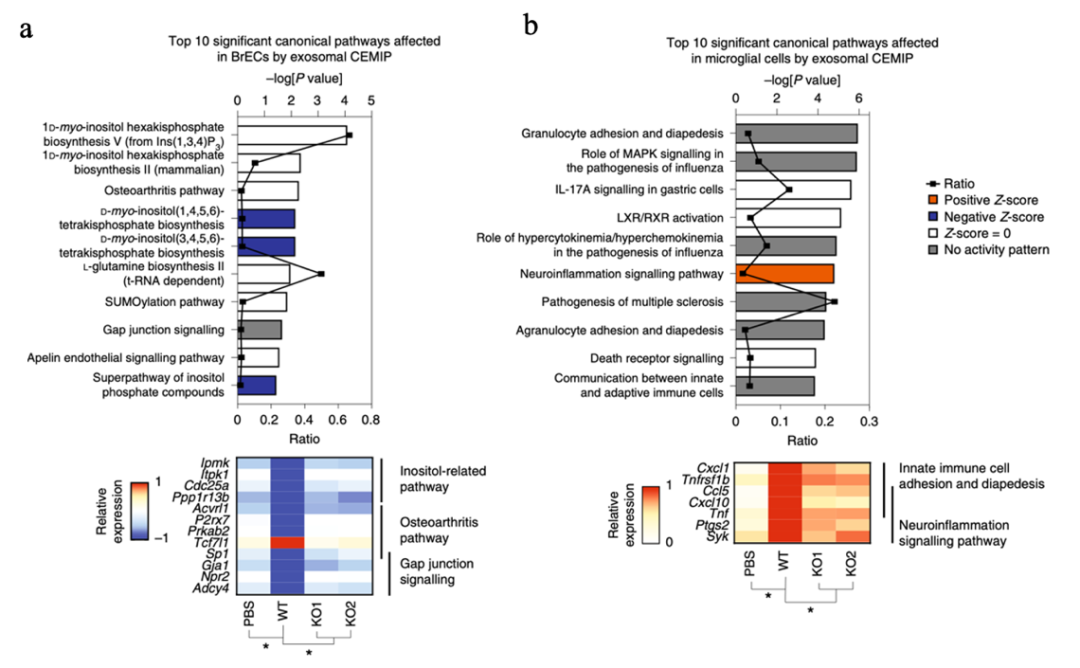
图7. 外泌体CEMIP改变内皮细胞和小胶质细胞中的基因表达
| 小结
近些年的研究已经充分表明,肿瘤细胞来源的外泌体在肿瘤细胞转移过程中发挥着至关重要的作用。肿瘤细胞分泌的外泌体富含母本细胞特异的功能性蛋白质,在肿瘤转移中发挥着“敢死队”的作用。通过蛋白质组学技术,可以对这些功能性的外泌体蛋白质进行广泛筛选。如何针对筛选出的差异外泌体蛋白质进行系统性机制研究?华盈视角依据本文的研究思路为各位粉丝总结了如下技术路线,供大家参考:

| 相关文献
1. Peinado H, Zhang H, Matei IR et al., Pre-metastatic niches: organ-specific homes for metastases. [J]. Nat Rev Cancer. 2017;17(5):302-317.
2. Peinado H, Alečković M, Lavotshkin S et al., Melanoma exosomes educate bone marrow progenitor cells toward a pro-metastatic phenotype through MET. [J]. Nat Med. 2012;18(6):883-891.
3. Costa-Silva B, Aiello NM, Ocean AJ et al., Pancreatic cancer exosomes initiate pre-metastatic niche formation in the liver. [J]. Nat Cell Biol. 2015;17(6):816-826.
4. Hoshino A, Costa-Silva B, Shen TL et al., Tumour exosome integrins determine organotropic metastasis. [J]. Nature. 2015;527(7578):329-335.
5. Rodrigues G, Hoshino A, Kenific CM et al., Tumour exosomal CEMIP protein promotes cancer cell colonization in brain metastasis. [J]. Nat Cell Biol. 2019;21(11):1403-1412.

地址:上海市闵行区绿洲环路396弄5幢4层
电话:400-869-2936,021-33968791
邮箱:support@wayenbiotech.com
传真:021-33938792
QQ:2120485725
战略合作
战略合作
| Full Moon | RayBiotech | CDI | IZON | Bio-Rad | R&D Systems | IsoPlexis | Akoya | 南模生物 | 欧易生物 | 上海实验动物研究中心 | 美吉生物 | 麦特绘谱 |
特别说明:本网所有网页均为华盈生物原创信息,转载必须征求华盈生物同意,并同时注明本网名称及网址。
专利代码