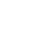新闻资讯
Nature Commun:外泌体脂质与胰岛素抵抗机制研究
- 分类:华盈视角
- 作者:小高
- 来源:
【概要描述】胞外小囊泡(sEVs)可以介导脂肪组织、肝脏、骨骼肌和免疫细胞之间的通讯联系,促进主要效应器官对胰岛素的耐受和敏感性,在肥胖及其代谢并发症的发展中发挥作用1。
Nature Commun:外泌体脂质与胰岛素抵抗机制研究
【概要描述】胞外小囊泡(sEVs)可以介导脂肪组织、肝脏、骨骼肌和免疫细胞之间的通讯联系,促进主要效应器官对胰岛素的耐受和敏感性,在肥胖及其代谢并发症的发展中发挥作用1。
- 分类:华盈视角
- 作者:小高
- 来源:
- 发布时间:2022-04-28 10:53
- 访问量:
胞外小囊泡(sEVs)可以介导脂肪组织、肝脏、骨骼肌和免疫细胞之间的通讯联系,促进主要效应器官对胰岛素的耐受和敏感性,在肥胖及其代谢并发症的发展中发挥作用1。华盈视角上一篇公众号文章 “Cell Metabolism:外泌体miRNA与胰岛素抵抗” 介绍了外泌体中的miRNA调控胰岛素抵抗作用机制的研究思路。华盈视角今天分享的新文章主要聚焦在外泌体脂质与胰岛素抵抗的机制研究策略上。
已有研究证明了生物活性脂质在非脂肪组织中的积累,也可以促进胰岛素敏感性的损害,异常高的细胞磷脂酰胆碱(PC)脂质会影响能量代谢,并与胰岛素抵抗有关2。基于前人研究基础,外泌体的脂质与胰岛素抵抗等代谢疾病的发生及演化关系就存在一定的想象空间,值得深入研究。而具体的研究思路,我们可参考2021年Nature Communications杂志上发表的题为“High-fat diet-induced upregulation of exosomal phosphatidylcholine contributes to insulin resistance”文章3。该研究发现高脂饮食(HFD)会显著改变肠道上皮外泌体的脂质谱,外泌体磷脂酰胆碱(PC)会与肝细胞中表达的芳烃受体(AhR,aryl hydrocarbon receptor)结合进而抑制胰岛素激活途径及其关键信号通路PI3K/Akt,造成胰岛素抵抗。本研究具体思路如下:
| 第一步:外泌体分离鉴定
首先,作者收集了高脂饮食(HFD)的肥胖小鼠或II型糖尿病患者的粪便样本(将粪便颗粒收集重悬于PBS 中并手动切碎),采用蔗糖密度梯度离心(图1A)的方法提取外泌体,并通过电镜(图1B)、NTA(图1C)、Western Blot(图1D)对外泌体进行了鉴定。随后,作者推测外泌体可能来源于肠道上皮细胞,所以通过Western Blot和免疫荧光检测了分离的外泌体中表达肠道上皮细胞marker A33蛋白(图1D)。
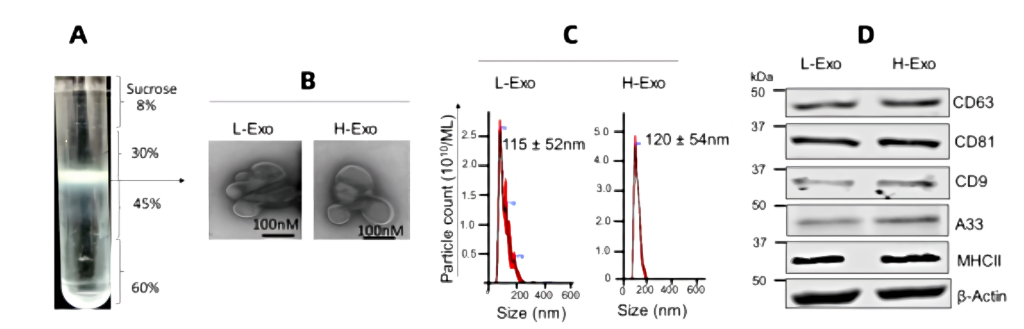
图1 L-Exo和H-Exo的电镜、粒径和Western blot鉴定
(L-Exo:瘦鼠来源的外泌体,H-Exo:肥胖鼠来源的外泌体)
| 第二步:体内实验验证外泌体功能
作者将高脂饮食(HFD)的肥胖小鼠或II型糖尿病患者的粪便样本中分离的外泌体通过灌胃给药瘦鼠后,发现瘦鼠产生了胰岛素抵抗性。主要表现在以下几个方面:
1)在注射葡萄糖和胰岛素后,H-Exos组的血液中葡萄糖残留量明显偏高(图2)。
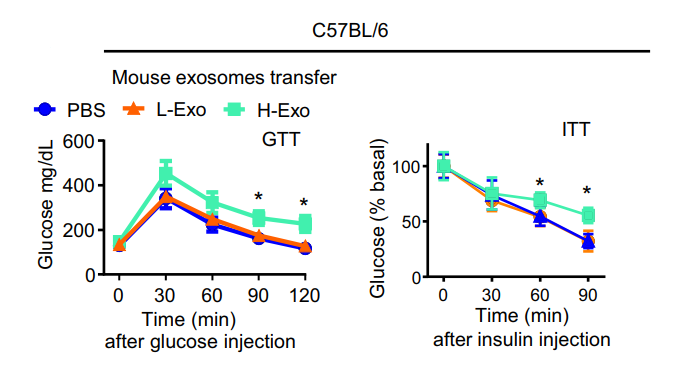
图2 葡萄糖耐受试验(GTT) 和胰岛素抵抗试验(ITT)
2)钳夹试验期间的葡萄糖输注率明显偏低(图3A),血糖水平明显偏高(图3B)。血浆胰岛素水平无显著改变(图3C)。
图3 钳夹试验(The clamp assay)
| 第三步:外泌体摄取实验
为了探究外泌体在何种器官富集以及被何种细胞摄取进而发挥作用,作者收集转染GFP的MC38细胞上清的外泌体(注:作者前面富集的外泌体为CD63+A33+的外泌体,认为粪便中的外泌体来自肠道上皮细胞)注射到小鼠结肠中,6小时后在小鼠肝脏中检测到GFP荧光信号(图4A)。说明结肠部位的外泌体通过循环到了肝脏处。体外实验通过PKH26标记的外泌体与Kupffe细胞(肝脏巨噬细胞)共培养,发现外泌体被肝脏巨噬细胞细胞摄取(4B、C)。
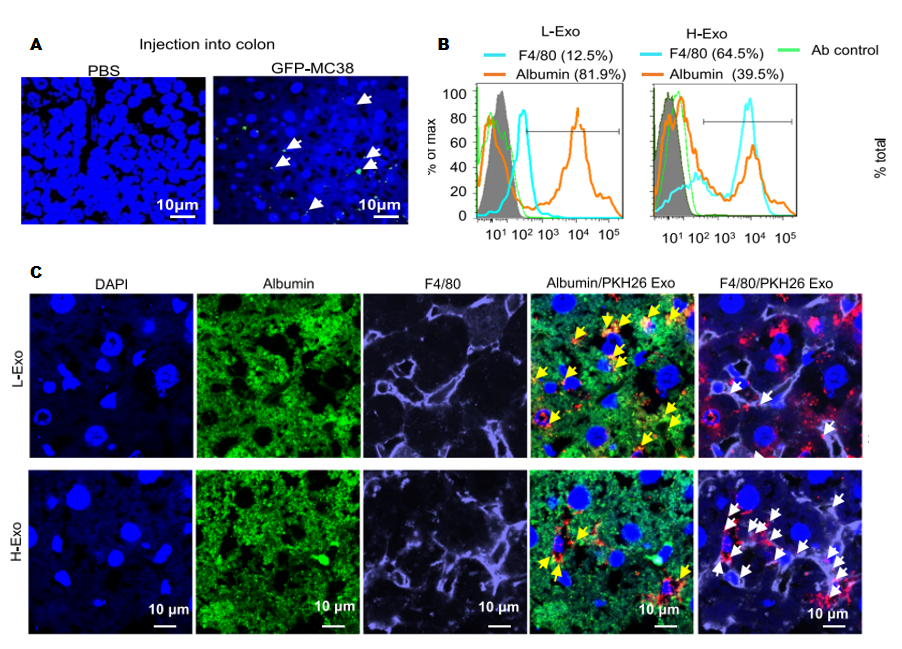
图4 Exos被肝脏巨噬细胞摄取
| 第四步:通过外泌体脂质组学确定功能分子
作者随后对L-Exo(低脂饮食小鼠外泌体)和H-Exo(高脂饮食小鼠外泌体)(图5A、B),进行了脂质组学分析,发现了磷脂酰胆碱(PC)在肥胖鼠来源的外泌体中显著升高(图5C)。

图5 L-Exo和H-Exo脂质组学分析
对Healthy-Exo(健康人外泌体)和T2D-Exo(II型糖尿病患者的外泌体)(图6A、B)进行了脂质组学分析,发现了磷脂酰胆碱(PC)在糖尿病患者来源的外泌体中显著升高(图6C)。
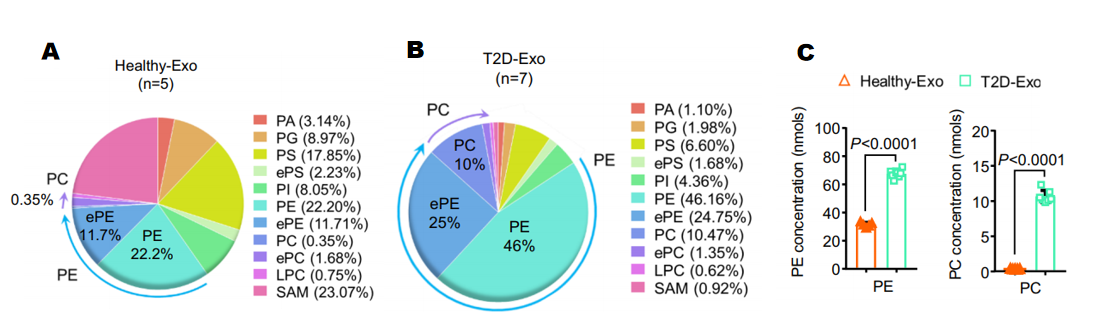
图6 Healthy-Exo和T2D-Exo脂质组学分析
通过人工构建高PC含量和低PC含量的外泌体(H-ExoLipds PC-:将H-Exo中的PC去除; L-ExoLipds PC+:将L-Exo中加入PC),注射到小鼠结肠中,发现注射L-ExoLipds PC+的小鼠血液中葡萄糖残留量较注射L-ExoLipds的小鼠明显偏高,而H-ExoLipds PC-的小鼠葡萄糖残留量与H-ExoLipds的小鼠相比显著降低(图7A),体外实验发现PCLipds处理和H-ExoLipds发挥和相同的功能,葡萄糖摄取明显降低(图7B),且PC含量较高的外泌体L-ExoLipds PC+和H-ExoLipds更多的被肝脏巨噬细胞摄取(图7C)。
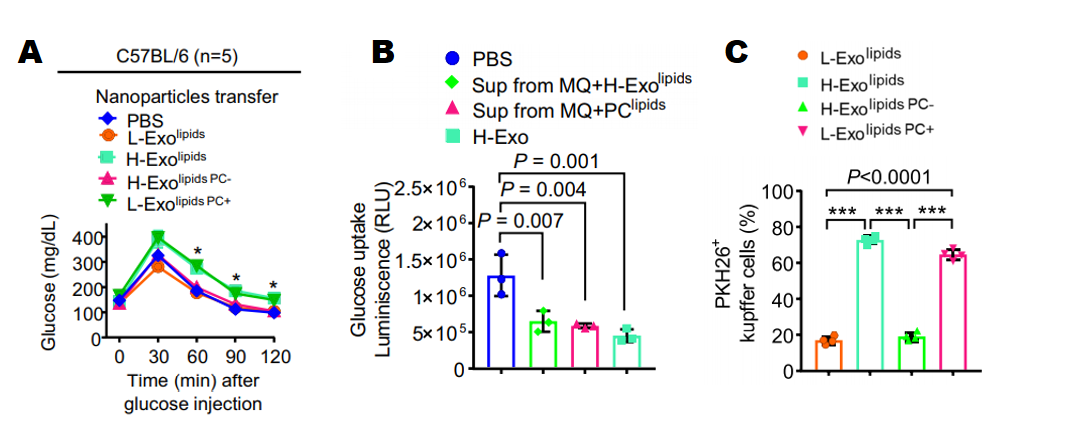
图7 外泌体PC的功能验证
| 第五步:确定外泌体功能分子的下游作用机制
1. 作者通过细胞因子抗体芯片广泛筛选了与胰岛素抵抗相关的细胞因子,结果发现H-Exo处理的小鼠血浆和巨噬细胞分泌的中TNF-α、IL-6含量显著上升,造成胰岛素抵抗(图8A)。
2. 有大量文献报道AHR调控胰岛素信号通路,于是,作者为探究H-Exo与AHR的关系,通过基因芯片发现H-Exo处理的小鼠肝脏组织中AHR等基因表达明显上调(图8B)。
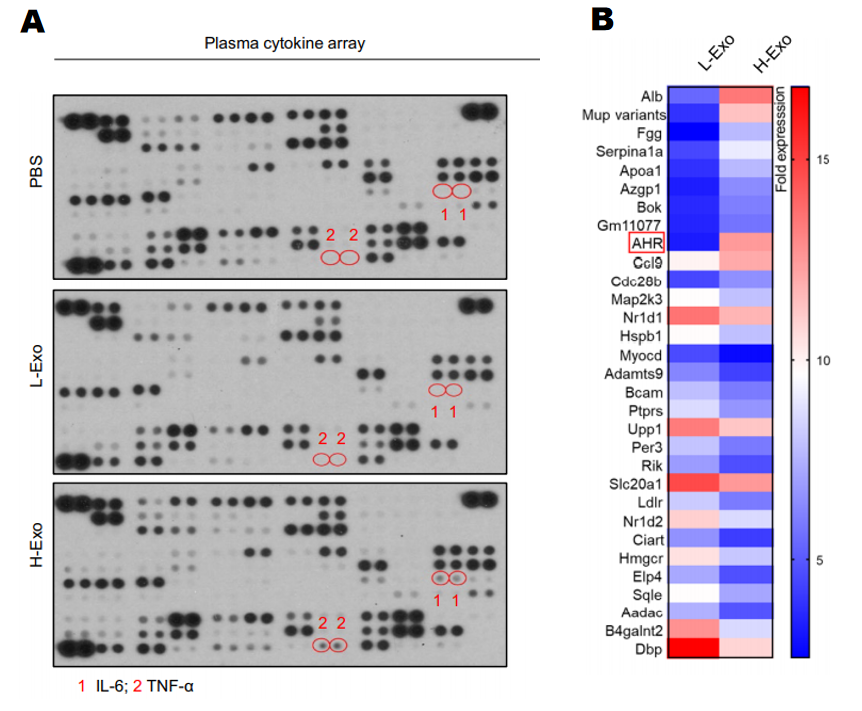
图8细胞因子芯片、基因芯片研究外泌体PC作用机制
3. 通过Western Blot验证H-Exo处理的小鼠肝脏组织中AHR蛋白表达也明显上调(图9A)。进一步,通过SPR技术(表面等离子共振)验证了外泌体来源的PC可直接结合并激活AhR(图9B)。
4. 通过PCR芯片发现胰岛素信号通路相关基因IRS-2及其下游基因PI3K和Akt的表达受到抑制(图9C)。并且缺失AHR后,外泌体对这些胰岛素信号通路基因的调控效果消失。说明外泌体通过激活AHR从而抑制下游的基因表达。
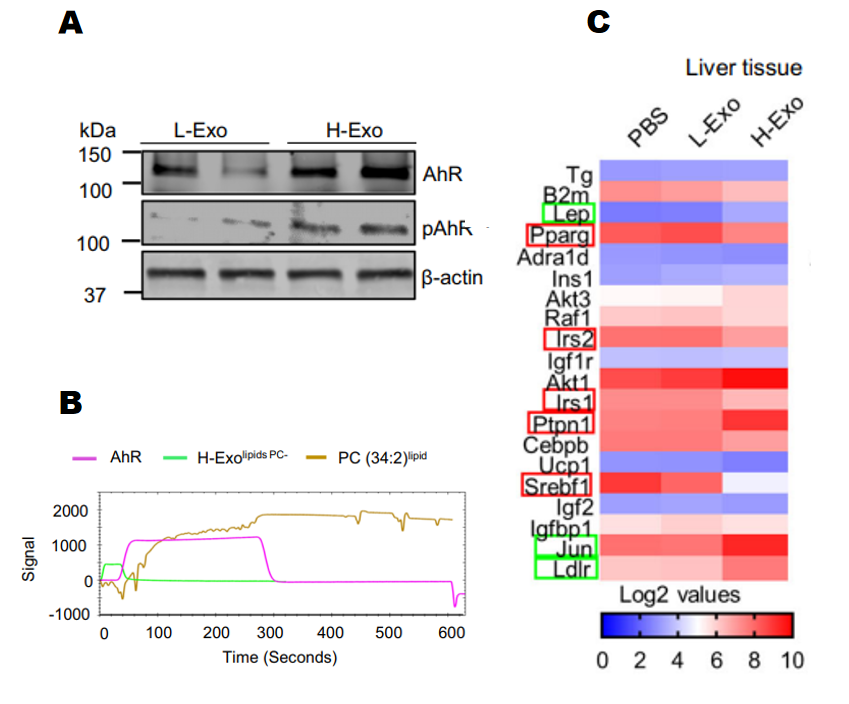
图9 SPR技术、PCR芯片研究外泌体PC作用机制
综上结果表明肠道H-Exo被巨噬细胞和肝细胞吸收,H-Exo的PC和受体细胞表面的AHR结合,激活AHR后可抑制下游胰岛素相关的基因表达和通路激活,从而对胰岛素抵抗产生调控作用。
| 小结与展望
上述案例解析为大家展示了经典的外泌体脂质参与疾病发生发展机制的研究思路和技术路线。文章围绕外泌体展开研究:首先对高脂饮食和正常饮食的小鼠进行外泌体的分离鉴定,发现高脂饮食小鼠或II型糖尿病患者的外泌体可以使瘦鼠产生胰岛素抵抗性。随后,通过外泌体示踪发现其被肝脏富集,并被肝细胞和巨噬细胞摄取。然后,利用脂质组学技术对正常饮食和高脂饮食的小鼠外泌体的脂质谱进行筛选。发现外泌体膜上的磷脂酰胆碱(PC)在高脂饮食小鼠分泌的外泌体中发生了显著改变。最后,通过敲低/过表达实验及各种芯片对外泌体如何调控受体细胞功能,造成胰岛素抵抗的机制综合论证。
针对外泌体脂质相关研究,华盈视角的粉丝也经常会提出一些实际工作中会遇到的高频问题,华盈视角小编也给大家提供一些建议:
Q1.外泌体中有各种蛋白、核酸,我们为什么要进行外泌体脂质研究?
1. 外泌体脂质含量多,类型多,目前有1116种脂质在外泌体中被发现,见Exocarta数据库,包括常见且含量较高的鞘磷脂(SM)、磷脂酰丝氨酸(PS)、磷脂酰丝氨酸(PI)、磷脂酸(PA)、神经酰胺(Cer)以及胆固醇4。
2. 外泌体脂质发挥重要的生物学功能,可参与免疫监视、肿瘤微环境的修饰或炎症的调节等5;
3. 外泌体脂质与外泌体蛋白、miRNA一样在医学上均可以被用作生物标志物6。然而,受制于技术手段的限制,对于脂质组的研究相较于核酸和蛋白仍然存在较大空白区。
Q2.针对外泌体脂质研究,采用何种外泌体提取方法更为合适?
外泌体提取常用的方法为超速离心法,对于脂质研究需要获得更高纯度的外泌体,建议采用密度梯度离心的方法,华盈生物可提供完备的密度梯度离心技术服务。
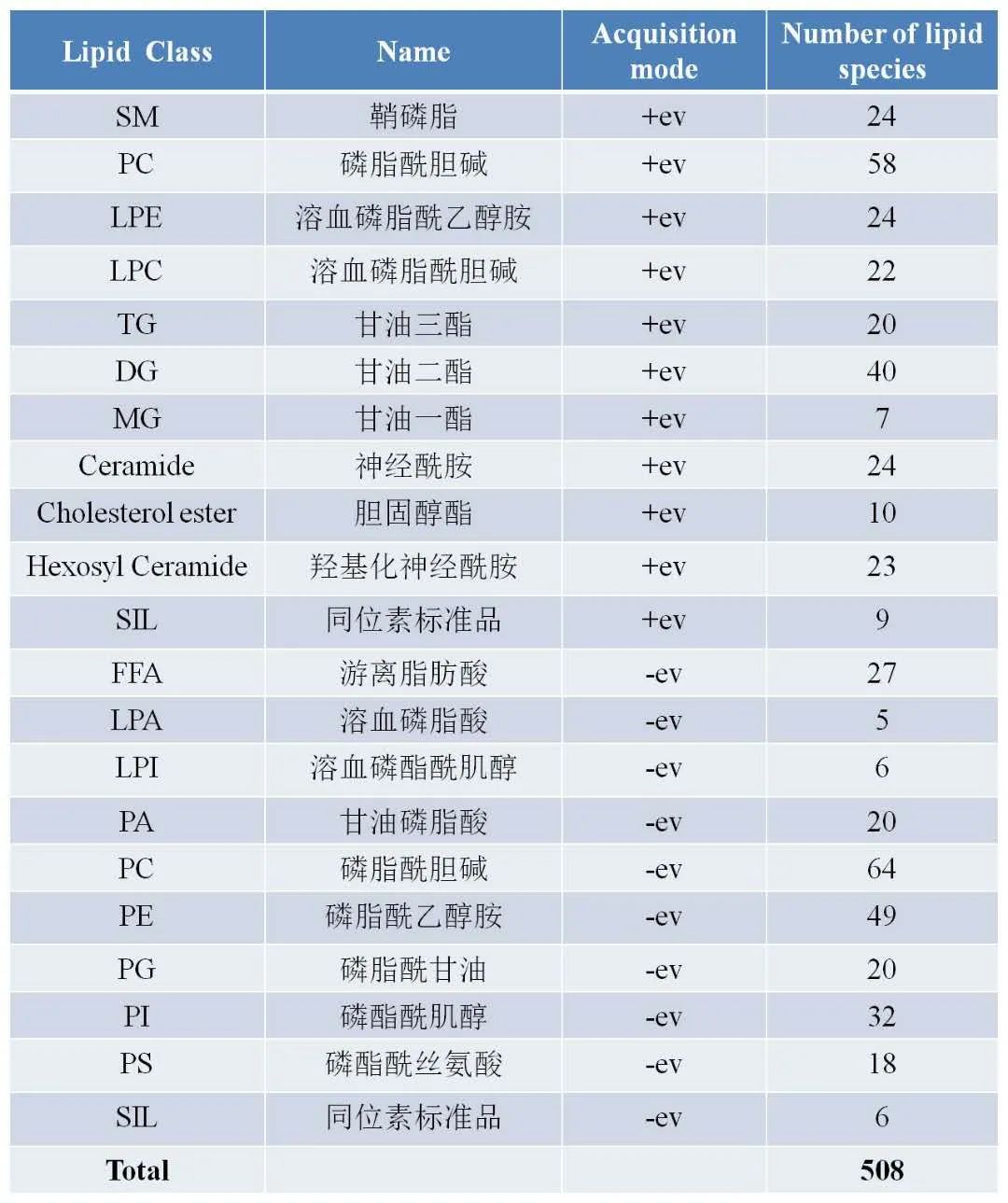
Q3.针对外泌体脂质研究,如何确定目标脂质分子?
在提取外泌体以后,我们可以通过质谱进行脂质组学检测,确定外泌体中脂质的含量及类别。华盈生物能够提供超过500种脂质的绝对定量筛选服务,涉及20多种亚类,包括:鞘磷脂(SM)、磷脂类(PC、PE、PG、PI、PS)、神经酰胺(Cer)和甘油酯(TG、DG),部分检测列表如下:
Q4.针对外泌体示踪,目前有什么常用的方法?
在确定外泌体受体细胞的时候,我们经常会采用到体内和体外实验进行外泌体示踪。在体外细胞摄取实验中,一般推荐常用的外泌体标记方法包括PKH26/DiO/花青素/量子点等,华盈生物可提供各种外泌体标记服务。
同时,我们特别推荐针对动物体内研究的外泌体标记示踪技术——量子点标记。作为是一种低毒、高灵敏、非侵入性的实时活体成像的方法,量子点具有优良的近红外(NIR)荧光,不仅具有较强的组织穿透性,而且可以极大程度避免体内示踪实验经常遇到的非特异荧光的干扰,是外泌体动物体内示踪的首选技术。
Q5.本文涉及到的外泌体脂质研究的技术,华盈生物是否都能够提供?
针对外泌体脂质下游机制研究,本文中用到的检测技术包括:密度梯度离心、脂质组学筛选技术、细胞因子抗体芯片、基因芯片/测序、SPR表面等离子各种技术、PCR芯片/信号通路芯片、外泌体示踪等,以上技术在华盈生物外泌体服务平台均可找到“一站式服务”。
丰富全面的外泌体功能研究手段全都在华盈生物的武器库中(红色为华盈生物特色服务),欢迎电话垂询:021-3393-8791。
| 相关文献
[1] Wei Y, Hong G, Reis F, et al. MiR-690, an exosomal-derived miRNA from M2-polarized macrophages, improves insulin sensitivity in obese mice. [J]. Cell Metabolism. 2021 Jan 7; S1550-4131(20)30717-8.
[2] Van der Veen, J. N. et al. A role for phosphatidylcholine and phosphatidylethanolamine in hepatic insulin signaling. [J]. The FASEB Journal, 2019. 33,5045–5057 (2019).
[3] Kumar A, Sundaram K, J Mu, et al. High-fat diet-induced upregulation of exosomal phosphatidylcholine contributes to insulin resistance. [J]. Nature Communications. 2021 Jan 11; 12(1):213.
[4] Record M, Silvente-Poirot S, Poirot M, et al. Extracellular vesicles: lipids as key components of their biogenesis and functions. [J]. Journal of Lipid Research, 2018 Aug 59(8):1316-1324.
[5] Record, Michel. Introduction to the Thematic Review Series on Extracellular Vesicles: a focus on the role of lipids. [J]. Journal of Lipid Research, 2018, 59(8): 1313–1315.
[6] Skotland T, Ekroos K, Kauhanen D, et al. Molecular lipid species in urinary exosomes as potential prostate cancer biomarkers. [J]. European Journal of Cancer, 2017, 70:122-132.

地址:上海市闵行区绿洲环路396弄5幢4层
电话:400-869-2936,021-33968791
邮箱:support@wayenbiotech.com
传真:021-33938792
QQ:2120485725
战略合作
战略合作
| Full Moon | RayBiotech | CDI | IZON | Bio-Rad | R&D Systems | IsoPlexis | Akoya | 南模生物 | 欧易生物 | 上海实验动物研究中心 | 美吉生物 | 麦特绘谱 |
特别说明:本网所有网页均为华盈生物原创信息,转载必须征求华盈生物同意,并同时注明本网名称及网址。
专利代码