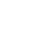新闻资讯
一起学习:如何使用4款芯片发表一篇JCI (IF: 12.282)
- 分类:华盈视角
- 作者:华盈生物
- 来源:
【概要描述】生物芯片技术是通过化学偶联的方法,将生物分子(寡核苷酸、抗体、抗原、组织等)高密度固着于硅片或磁珠表面的生物检测技术,包含:基因芯片、蛋白质芯片、抗体芯片、组织芯片等家族成员。由于具备高通量检测的特性,生物芯片可以为生物医学领域的研究人员提供广泛而可靠研究数据。
一起学习:如何使用4款芯片发表一篇JCI (IF: 12.282)
【概要描述】生物芯片技术是通过化学偶联的方法,将生物分子(寡核苷酸、抗体、抗原、组织等)高密度固着于硅片或磁珠表面的生物检测技术,包含:基因芯片、蛋白质芯片、抗体芯片、组织芯片等家族成员。由于具备高通量检测的特性,生物芯片可以为生物医学领域的研究人员提供广泛而可靠研究数据。
- 分类:华盈视角
- 作者:华盈生物
- 来源:
- 发布时间:2022-05-23 14:10
- 访问量:
生物芯片技术是通过化学偶联的方法,将生物分子(寡核苷酸、抗体、抗原、组织等)高密度固着于硅片或磁珠表面的生物检测技术,包含:基因芯片、蛋白质芯片、抗体芯片、组织芯片等家族成员。由于具备高通量检测的特性,生物芯片可以为生物医学领域的研究人员提供广泛而可靠研究数据。在高质量的文献中,生物芯片技术已经是获取全面生物信息的普遍方式,如何合理应用多种生物芯片技术,在省时省力的同时,获得高质量的科学成果,是众多研究人员都希望了解的秘密。
华盈视角以华盈生物合作伙伴——复旦大学肿瘤研究所王建华教授课题组发表的一篇J Clin Invest (IF: 12.282)经典文章为例[1],为大家揭开这个谜底:


乳腺癌(BrCa)是严重威胁女性健康的最常见的恶性肿瘤,虽然系统的治疗方法已经降低了癌症特异性死亡率,但是BrCa仍然具有高复发率和转移率。因此,研究BrCa发生和进展的分子机制对BrCa临床诊断和治疗意义重大。肿瘤细胞的生长需要合适的肿瘤微环境,肿瘤微环境中会包含多种类型的基质细胞,其中癌相关成纤维细胞(CAFs)是参与肿瘤发生、增殖、侵袭和新生血管形成的最丰富的细胞类型,它主要由基质中正常的成纤维细胞(NAFs)转化而来。
位于染色体17p13.3上的转录因子HIC1 (hypermethylated in cancer 1),与著名抑癌基因TP53的染色体定位非常接近。而HIC1在多种癌症组织中普遍高度甲基化,表现为表观遗传沉默和表达量低,这说明HIC1很可能是一个潜在的抑癌基因。
| Step 1:TCGA和Oncomine数据库确认研究目标分子HIC1
为确认HIC1基因是否在乳腺癌患者肿瘤组织中低表达,研究人员分析了两个常用的肿瘤数据库:TGCA和Oncomine中的数据。发现TCGA数据库收录两个研究案例中,HIC1基因在乳腺癌组织中的mRNA表达量显著低于正常组织,同时发现高分期乳腺癌组织中HIC1基因表达量更低(图1A)。TGCA数据反映的现象得到了Oncomine数据库的进一步印证(图1B)。同时,由于两个数据库记录的研究案例具有大量临床样本随访信息,利用Kaplan-Meier Plotter分析,研究人员还证实了HIC1高表达的乳腺癌病人相对具有更低的复发率。以上两款公共数据库资料的分析,帮助研究人员明确了HIC1基因具有深入研究的价值。
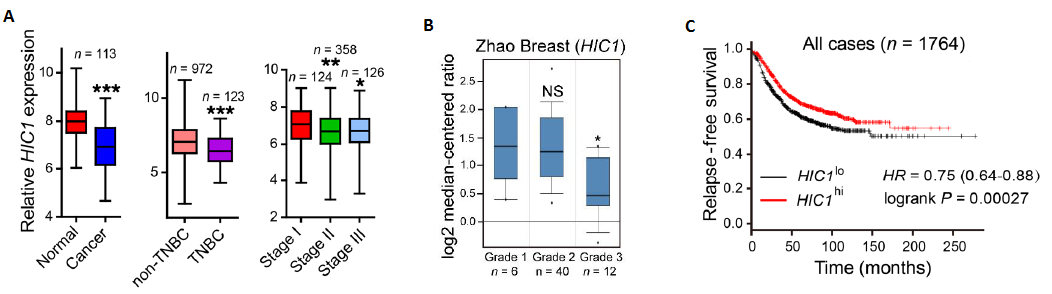
图1. TCGA和Oncomine数据库分析锁定HIC1的研究价值
| Step 2:构建HIC1基因敲除小鼠和细胞模型确认HIC1与乳腺癌发生的直接关系
为了研究HIC1在BrCa进展中的作用,研究人员构建了条件性敲除HIC1基因的Cre-Lox小鼠,通过将表达Wap-Cre的小鼠与Hic1fl/fl小鼠杂,获得仅在乳腺上皮细胞特异敲除HIC1基因的Cre-positive Hic1fl/fl小鼠,并将Cre-negative Hic1fl/fl作为对照组命名为Hic1+/+组。
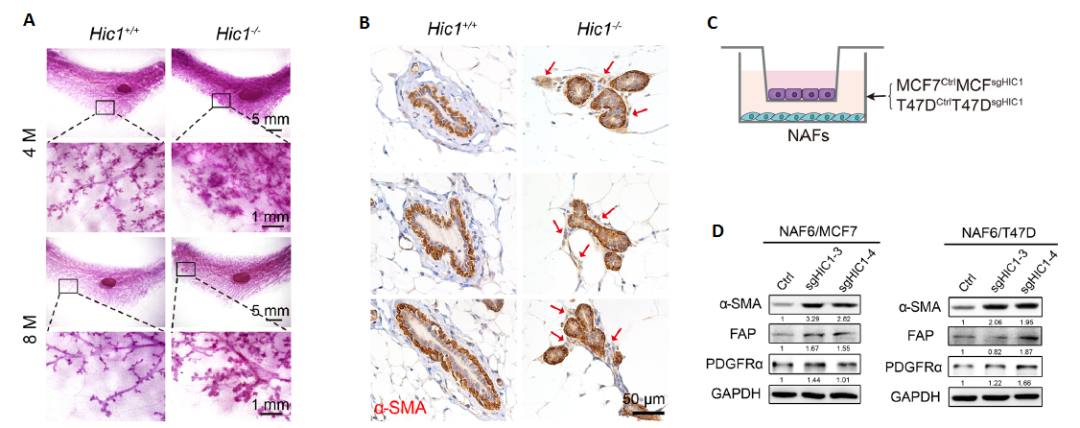
图2. 体内-体外实验确证HIC1基因与乳腺癌发生的直接关系
相比较对照组,HIC1基因敲除后,胭脂红染色后电镜观察显示,小鼠乳腺导管树发生了显著改变(图2A)。已有研究表明HIC1缺失可能引起基质细胞(NAFs)分泌特殊因子从而调节基质微环境。研究人员进行了小鼠乳腺组织免疫组化分析,结果显示HIC1缺失小鼠的乳腺基质中癌相关成纤维细胞(CAFs)代表的标志物蛋白α-SMA(α-smooth muscle actin)出现了强阳性信号,说明NAFs可能被显著活化转变为CAFs(图2B)。
研究人员想进一步在体外验证这一发现,用CRISPR-Cas9技术获得了HIC1缺失的两种管腔BrCa细胞系,MCF7sgHIC1和T47DsgHIC1。研究人员将MCF7CtrlMCF7sgHIC1和T47DCtrlT47DsgHIC1分别与原代NAFs通过Transwell小室进行共培养(图2C)。利用Western blot等技术检测MCF7sgHIC1 T47DsgHIC1共培养的原代NAFs中α-SMA的表达量,结果显示为α-SMA表达显著增加,即证明NAFs确实可以被BrCa细胞通过间接的方式被活化成为 CAFs(图2D)。
| Step 3:基因表达谱芯片发现CAFs活化因子CXCL14
由于前期实验证实,HIC1缺失的BrCa细胞系和原代NAFs细胞共培养,会促进NAFs向CAFs细胞转化,而且是通过间接的方式完成的。那么,最有可能的情况是BrCa细胞培养上清中的分泌蛋白穿过Transwell小室的分隔膜,到达NAFs培养层中,诱导其活化成为CAFs细胞(微环境概念)。
图3 确定抑制性转录因子HIC1的下游靶基因CXCL14
在2014年,王建华教授课题组发表在Cancer Res上的一个研究工作中[2],利用基因表达谱芯片的方式系统筛选了过表达HIC1的BrCa细胞系MDA-MB-231和敲除HIC1的BrCa细胞系HBL-100中的表达谱变化,发现了一系列细胞因子的mRNA表达水平受到了HIC1的调控。其中趋化因子CXCL14((C-X-Cmotif 14)表达在HIC1敲除的HBL-100细胞系中上调最为显著(图3A)。在本研究中,研究人员合理利用前期工作基础中的芯片数据,将CXCL14锁定为HIC1的主要调控靶基因。同时,在MCF7sgHIC1、T47DsgHIC1和MDA-MB-231HIC1细胞系中,利用RT-PCR和免疫组化实验证实了CXCL14的mRNA和蛋白表达确实均受到了HIC1的负向调控。
由于HIC1是一个抑制性转录因子,可以直接结合到靶基因的启动子区域。为进一步确定CXCL14是否是HIC1潜在的下游靶标,研究人员通过转录因子预测分析发现CXCL14基因启动子区域有11个HIC1结合位点(TGCC/GGCA),并构建了覆盖CXCL14基因5’启动子区域–2000~ +136区段的荧光素酶报告质粒(图3B)。将质粒转入293T和MCF7细胞系中,均发现HIC1可结合CXCL14基因启动子区域中的–2000~ +136、 -726~ +136和-276~ +136区段,并显著抑制CXCL14基因的表达(图3C)。随后,Chip-PCR实验也证实了HIC1可以特异性结合于 CXCL14 启动子序列(图3D)。上述结果明确证实了HIC1对CXCL14基因的负向调控作用。
| Step 4:20K人类蛋白质组芯片锁定CXCL14的受体GRP85
那么,BrCa细胞分泌出的CXCL14又是如何诱导NAFs活化成为CAFs细胞的呢?
细胞因子(趋化因子也是细胞因子的一种)是细胞间通讯的重要工具,是微环境研究的重要靶标。研究人员认为BrCa细胞分泌出的CXCL14需要通过结合NAFs膜上的受体,进而激活受体下游信号通路,引起NAFs向CAFs转化。研究人员利用biotin-CXCL14处理NAFs,加入Cy5-streptavidin免疫荧光,电镜观察证实了CXCL14定位在NAFs细胞膜上(图4A)。明确了CXCL14的结合蛋白,可能是膜受体。
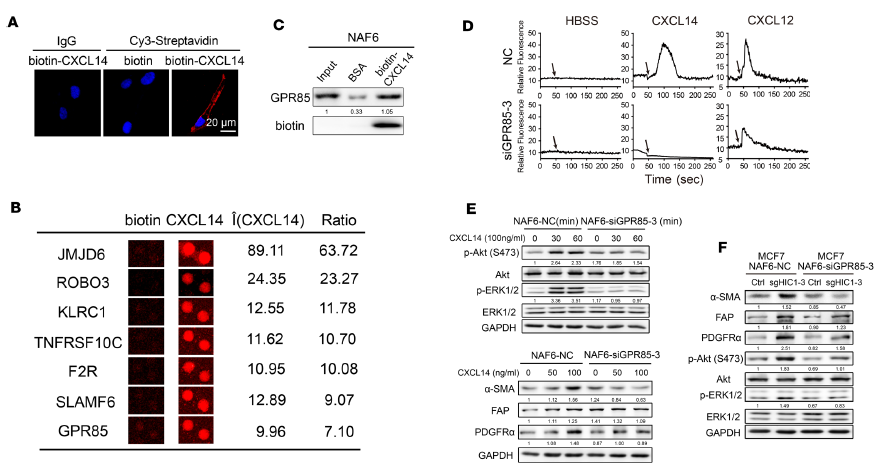
图4. 分析CXCL14调控的NAFs信号通路
进一步,研究人员与华盈生物合作,利用20K人类蛋白质组芯片技术,迅速筛选了biotin-CXCL14直接结合蛋白,共发现芯片上有32种膜蛋白与biotin-CXCL14蛋白存在直接结合。其中7种 GPCR蛋白及5次跨膜蛋白被重点关注(图4B)。经过pull-down实验,研究人员证实了GPR85(orphan GPCR)可以在体内环境中与biotin-CXCL14结合(图4C)。进一步,研究人员检测了CXCL14处理后的NAF6细胞中的Ca+离子内流情况,发现当GPR85被siRNA抑制后,CXCL14处理引起的Ca+离子内流即消失(图4D),说明GPR85是响应CXCL14信号的重要功能受体。
前人研究表明,ERK1/2、Akt信号通路的激活是NAFs向CAFs转化的重要通路。研究人员用Western blot证实了100 ng/mL CXCL14处理的NAF6细胞中,ERK1/2、Akt磷酸化成时间依赖效应地上调,同时,CAFs活化的标志物蛋白α-SMA也相应上调。然而,当GPR85被siRNA抑制后,上述现象均逐渐消失(图4E)。在Transwell共培养体系中,MCF7细胞也可以引起共培养的NAF6细胞中ERK1/2、Akt磷酸化水平和α-SMA蛋白表达水平的上调,当GPR85被siRNA抑制后,这些现象也受到了抑制。
| Step 5:细胞因子抗体芯片发现BrCa细胞EMT化的关键通路CCL17-CCR4
上述研究证实了BrCa细胞通过分泌出的CXCL14蛋白,结合于NAFs膜表面GPR85,激活ERK1/2和Akt通路诱导NAFs转化为CAFs,为BrCa细胞创造了恶性增殖和转移的微环境。那么,BrCa又是怎样实现转移的呢?
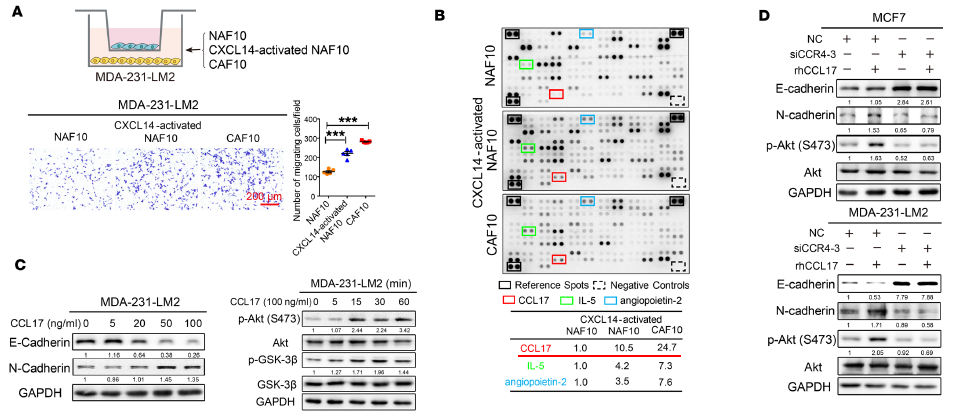
图5. CAFs细胞促进BrCa细胞发生EMT转化
研究人员重新构建了共培养体系,将MDA-231-LM2细胞(BrCa细胞)与初始NAF10或初始CAF10细胞进行共培养,并进行CXCL14刺激。电镜观察发现与CAF10或者CXCL14处理后的NAF10共培养的MDA-231-LM2细胞发生了显著的转移,穿透了Transwell分隔膜(图5A)。为筛选CAF10和CXCL14处理后的NAF10细胞培养上清中的分泌蛋白,研究人员果断采用了高通量的细胞因子抗体芯片技术,对102种细胞因子进行了广泛筛选,锁定了3种细胞因子在CAF10和CXCL14处理后的NAF10细胞培养上清中显著上调,其中CCL17上调最为显著(图5B)。于是,研究人员单独采用CCL17处理MDA-231-LM2细胞4天后,Western blot实验显示,处理后的MDA-231-LM2细胞中EMT(上皮间质转化)的标志物蛋白E-Cadherin显著下调,而N-Cadherin显著上调,说明MDA-231-LM2细胞发生了EMT现象,而与之对应的是Akt/GSK-3β通路的激活(图5C)。前人研究确认了CCL17的受体为CCR4,研究人员用siRNA敲除了MCF7和MDA-231-LM2细胞的CCR4后,再用CCL17进行处理,发现两种BrCa细胞中的EMT标志物E-Cadherin的下调和N-Cadherin上调现象受到了抑制,Akt/GSK-3β通路的激活也受到了抑制(图5D)。上述结果说明转化后的CAFs细胞会通过分泌CCL17进一步与BrCa细胞膜上的CCR4受体结合,通过激活Akt/GSK-3β通路,促进BrCa细胞发生EMT,实现远端转移。
| Step 6:组织芯片验证HIC1-CXCL14-CCL17轴在乳腺癌转移中的作用
为进一步确定上述机理研究的结论是否能够得到临床样本的证实,研究人员采用了高密度组织芯片技术检测了228例BrCa患者的上皮细胞HIC1、基质细胞CXCL14、基质细胞CCL17、基质细胞GPR85和上皮细胞CCR4的蛋白表达。结果发现:恶性BrCa患者上皮细胞核HIC1普遍低表达,基质CXCL14、CCL17、GPR85和上皮CCR4普遍高表达(图6A)。上皮HIC1和基质CXCL14表达水平呈负相关,基质CXCL14和CCL17表达水平呈正相关(图6B),该结果与前期机理研究结论一致。最终彻底证实了HIC1-CXCL14-CCL17轴在乳腺癌转移中的核心机制。
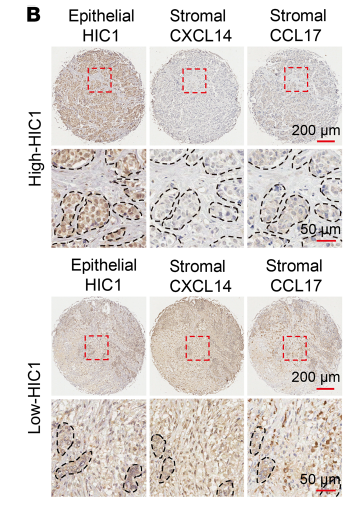
图6. 临床组织样本中的HIC1/CXCL14/CCL17表达情况
| 小结讨论
肿瘤微环境和EMT研究是近年来生物医学研究的热点,而生物芯片技术为代表的高通量组学技术近年来也蓬勃发展。很多华盈视角的粉丝朋友要求我们能够用实例详细剖析技术和科学两者之间如何能够完美结合这一主题?终于等到了这样一篇经典的Clin Invest文献与大家一起分享。
该文献以乳腺癌的转移为研究主题,通过3个数据库(Oncomine、TCGA和Kaplan-Meier Plotter)的联合应用发现肿瘤低表达的转录因子HIC1为起始,系统运用了基因表达谱芯片、20K人类蛋白质组芯片、细胞因子抗体芯片、组织芯片和Cre-LoxP基因敲除小鼠等一系列研究手段,层层深入,为大家逐步揭开了BrCa细胞与NAFs细胞互相调控的完美机理。即:BrCa细胞由于过甲基化作用导致抑制性转录因子HIC1表达量降低,进一步引起其对CXCL14的表达抑制的降低,从而造成BrCa细胞大量分泌CXCL14。当BrCa细胞分泌过量的CXCL14进入组织间隙后,CXCL14会到处游走,与NAFs细胞膜上的GPR85受体结合,激活受体下游的ERK1/2、Akt信号通路从而活化NAFs,使其转变为具有CAFs特性的细胞。基质中这种转化而来的CAFs,又会大量分泌细胞因子CCL17,由于是分泌蛋白,CCL17也会在组织间隙中游走,最终回归到BrCa细胞膜上,与其膜上的受体CCR4结合,激活Akt/GSK-3β信号通路从而促使BrCa细胞产生EMT现象(表现为E-Cadherin的下调和N-Cadherin上调),进而获得远端转移和侵袭能力(见图7)。该研究经过系统分析,严谨论证,最终揭开了乳腺癌恶性增殖和转移的明确潜在机理,为临床乳腺癌的特异性诊疗提供了新思路。
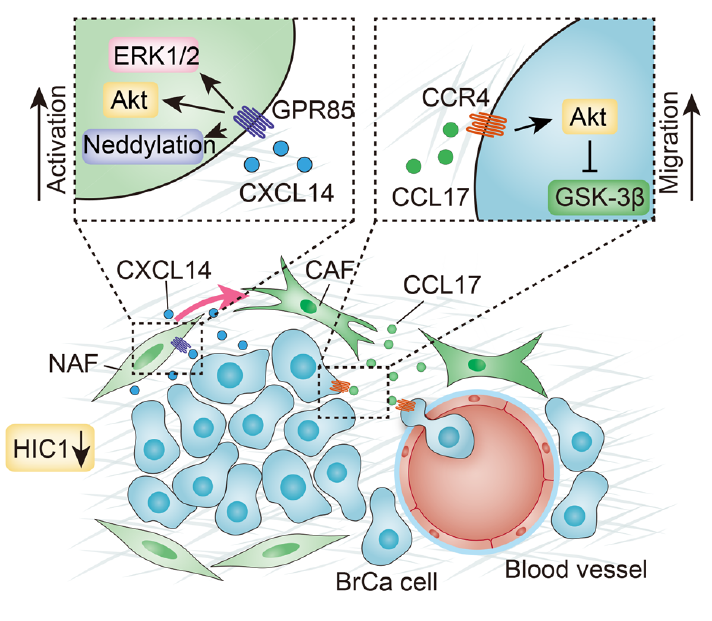
图7 乳腺癌转移分子机理图
相信粉丝们在读完这样的文章,在感叹作者周密的逻辑思维的同时,也会思考自己的研究工作中是否也能够用到这些芯片和数据库。答案是肯定的,文章中涉及到的所有组学技术,华盈生物都可以提供服务,华盈视角公众号也会为大家将来在发表自己J Clin Invest文章的时候提供专业上的帮助。
| 相关阅读:
1. 上交大研究团队揭示明星基因PTEN抗肿瘤新机制
2. J Hepatol (IF: 18.946):第二军医大学团队发现新的乙肝病毒基因亚型可预测中期肝癌的预后
1. Wang Yingying,Weng Xiaoling,Wang Luoyang et al. HIC1 deletion promotes breast cancer progression by activating tumor cell/fibroblast crosstalk.[J] .J. Clin. Invest., 2018, 128: 5235-5250.
2. Cheng Guangcun,Sun Xueqing,Wang Jinglong et al. HIC1 silencing in triple-negative breast cancer drives progression through misregulation of LCN2.[J] .Cancer Res., 2014, 74: 862-72.

地址:上海市闵行区绿洲环路396弄5幢4层
电话:400-869-2936,021-33968791
邮箱:support@wayenbiotech.com
传真:021-33938792
QQ:2120485725
战略合作
战略合作
| Full Moon | RayBiotech | CDI | IZON | Bio-Rad | R&D Systems | IsoPlexis | Akoya | 南模生物 | 欧易生物 | 上海实验动物研究中心 | 美吉生物 | 麦特绘谱 |
特别说明:本网所有网页均为华盈生物原创信息,转载必须征求华盈生物同意,并同时注明本网名称及网址。
专利代码