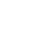新闻资讯
透过单细胞技术的历史沿革发现预判肿瘤免疫治疗临床结局的全新手段
- 分类:华盈视角
- 作者:瑞瑞
- 来源:
【概要描述】免疫治疗已经让部分难治的晚期肿瘤患者获得了良好的预后效果,但还有大部分病人并没有对anti-PD-1或者anti-CTLA4等免疫治疗做出应答,出现了免疫抵抗。
透过单细胞技术的历史沿革发现预判肿瘤免疫治疗临床结局的全新手段
【概要描述】免疫治疗已经让部分难治的晚期肿瘤患者获得了良好的预后效果,但还有大部分病人并没有对anti-PD-1或者anti-CTLA4等免疫治疗做出应答,出现了免疫抵抗。
- 分类:华盈视角
- 作者:瑞瑞
- 来源:
- 发布时间:2022-05-16 13:27
- 访问量:
免疫治疗已经让部分难治的晚期肿瘤患者获得了良好的预后效果,但还有大部分病人并没有对anti-PD-1或者anti-CTLA4等免疫治疗做出应答,出现了免疫抵抗。因此鉴定能够预测哪些病人对免疫治疗做出应答或抵抗的标志物成为了非常重要的一项任务。T细胞是抗肿瘤免疫最主要的适应性免疫系统,目前大部分免疫治疗聚焦于T细胞,尤其是效应性CD8+ T细胞。T细胞类型、表型、功能效应及本身的分子表达谱(RNA、蛋白、表观调控等)已经被广泛的证明可以作为预测免疫治疗应答或抵抗的有力标志物。
然而在肿瘤组织内,很多T细胞会出现功能障碍,失去了消灭肿瘤细胞的能力。有报道发现肿瘤组织内仅有10%的CD8+ T细胞具有识别肿瘤细胞的能力。虽然增加的免疫侵润与免疫治疗响应的提高具有相关性,但是免疫侵润和肿瘤反应性并不是一致的。肿瘤侵润淋巴细胞(TILs)中除了肿瘤反应性T细胞,还有一类称为“旁观者”的T细胞,这类细胞不能对抗原起反应,不会引起抗肿瘤效果。以上这些引起了一个非常重要的问题,到底哪一类T细胞具有肿瘤反应性。鉴定这类具有肿瘤反应性的T细胞亚群对于理解抗肿瘤免疫、开发新的免疫治疗策略势必意义深远。
多项研究已经报道发现了介导免疫治疗响应的T细胞并不是预先存在组织中的耗竭型T细胞的重新恢复,而是由外周来源的T细胞所替代,发挥抗肿瘤作用。这些新的克隆扩增的外周T细胞同样可以作为预测免疫治疗的标志物。这些研究开启了免疫治疗后对血液T细胞的研究,从而更易于标志物的临床转化。
| 单细胞技术与免疫治疗
单细胞技术已经发现了与免疫治疗相关的关键细胞亚群,包括不同类型的恶性细胞和免疫细胞。单细胞技术揭开了肿瘤微环境的异质性,鉴别了很多CD8+ T细胞亚型与免疫治疗应答具有很强的相关性。
T细胞亚型作为预测免疫治疗应答的标志物
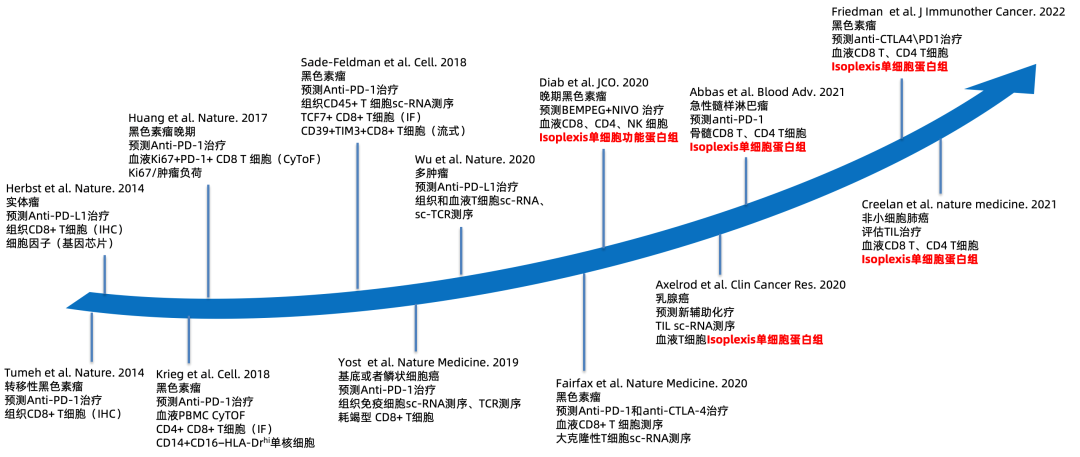
在单细胞应用于免疫治疗研究的历史沿革中,早期基于组织免疫组化的研究证实了在anti-PD-1治疗的应答黑色素瘤病人的侵袭肿瘤边缘, 不管是治疗前还是治疗后相对于无应答者CD8+ T细胞在应答患者中的增殖会显著增加。相一致的,CD8+ T细胞的效能分子Granzyme B也在应答患者免疫治疗后显著增加[1]。
CD8\Ki67双色免疫组化
| 流式分析
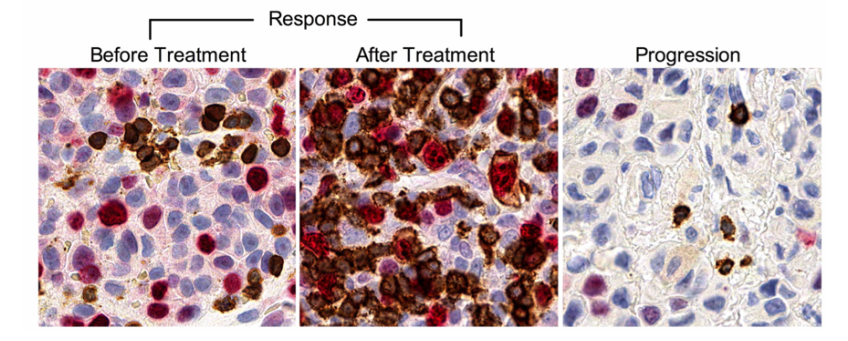
然而组织中检测并不是一个最优的标志物研究方案,2017年Wherry团队在Nature发文发现了黑色素瘤病人外周血中与anti-PD-1或者anti-CTLA-4治疗显著相关的T细胞亚型[2]。他们利用高维度的流式细胞术发现了免疫治疗后Ki67+ PD-1+ CD8 T细胞显著增多。但是虽然治疗后有大约74%的病人外周血中Ki67+ PD-1+ CD8 T细胞增加,但是仅有38%的病人获得临床受益,因此单独的Ki67+ PD-1+ CD8 T细胞并不能预测免疫治疗效果。这也暗示了可能存在更细分的细胞亚群或其他的影响因素与治疗效果相关。研究者之后发现了Ki67+ PD-1+ CD8 T细胞与肿瘤负荷(TB)具有显著的相关性。Ki67的高表达也代表着高的肿瘤负荷,因此Ki67+ PD-1+ CD8 T细胞增多反而预示着预后不良。最终研究者提出了利用Ki67+ PD-1+ CD8 T细胞与肿瘤负荷的比值可以预测对免疫治疗的效果,治疗后Ki67/TB >1.94的患者具有高的总体生存率。
预测anti-PD-1治疗
除了T细胞的类型变化,T细胞的效应分子同样与免疫治疗具有相关性,就像上述CD8+ T细胞的效能分子Granzyme B。Krieg等利用质谱流式(CyTOF)和FlowSOM分析了黑色素瘤病人在anti-PD-1治疗前后外周血PBMC中的不同类型的细胞变化[3]。他们发现了外周血中总的CD4+ 或CD8+ T细胞的比率在应答患者中显著下降,但是利用CyTOF分析T细胞的多种功能细胞因子,发现了每个细胞因子在治疗前后的变化不尽一致,但是通过因子组合性的分析方法,研究者发现了CD4+ T细胞的3种类型的因子组合在应答患者中显著增加,CD8+ T细胞有13种类型的因子组合在应答患者中显著增加。这个研究说明了T细胞的功能性细胞因子也可以作为预测免疫治疗是否应答或抵抗。
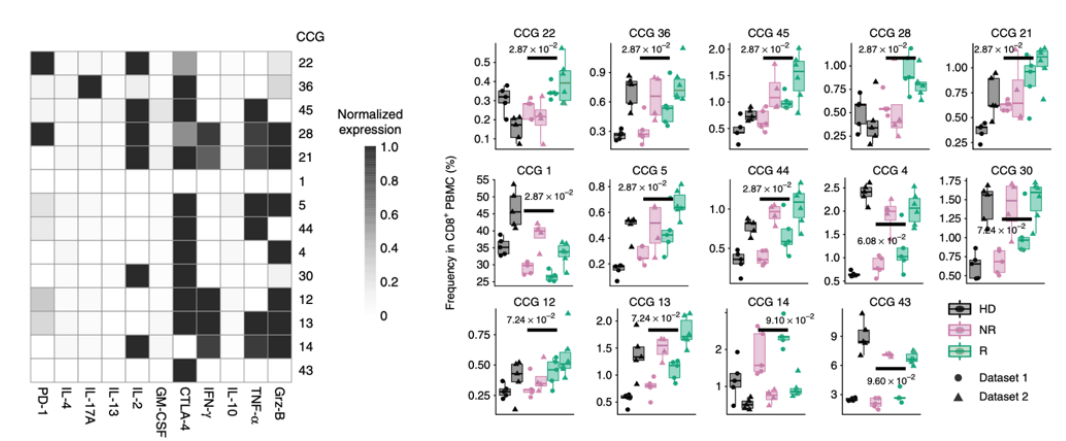
CD8+ T细胞的不同因子组合(CCG)在应答和无应答间的差异
| 单细胞测序
流式分析因其有限的marker限制了新类型细胞亚型的发现,而单细胞转录组测序(sc-RNA)以无偏的检测方式结合各种高级的生信分析方法已经成为了肿瘤免疫研究领域最常用的技术手段。Sade-Feldman等人利用sc-RNA测序分析了转移性黑色素瘤患者在anti-PD1或anti-CTLA4+PD1治疗前后组织中的淋巴细胞(CD45+)[4]。聚焦分析CD8+ T细胞,结果鉴别了2种类型的CD8+ T细胞,其中一类高表达TGF7基因的CD8+ T细胞在应答患者中显著增加,通过免疫荧光验证了TCF7+CD8+ T细胞与免疫治疗应答具有显著相关性,可以作为预后标志物。同时还发现了表达耗竭型marker TIM3 和CD39的CD8+ T细胞在无应答患者中显著富集。同时靶向这2个耗竭型marker可以增加anti-PD1的抗肿瘤效果。
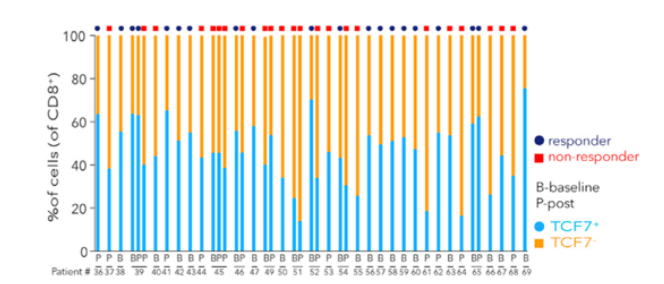
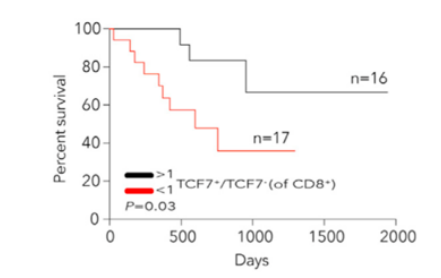
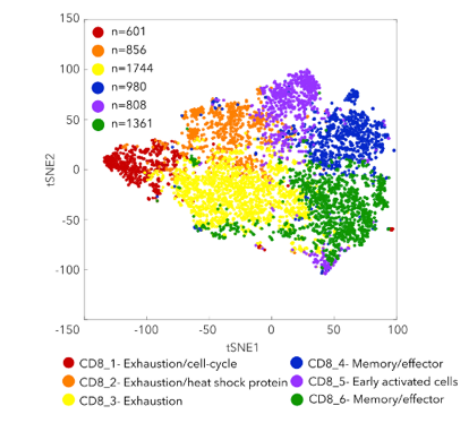
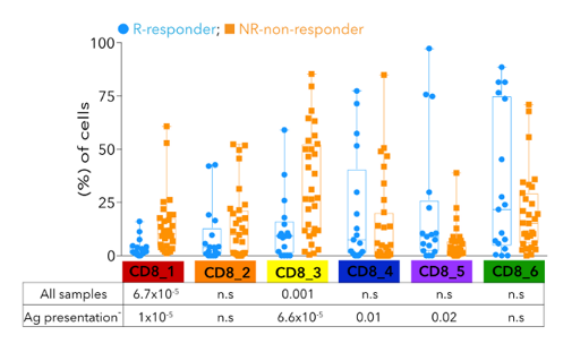
sc-RNA测序发现预测免疫治疗应答的CD8+ T细胞亚型
| 单细胞TCR测序
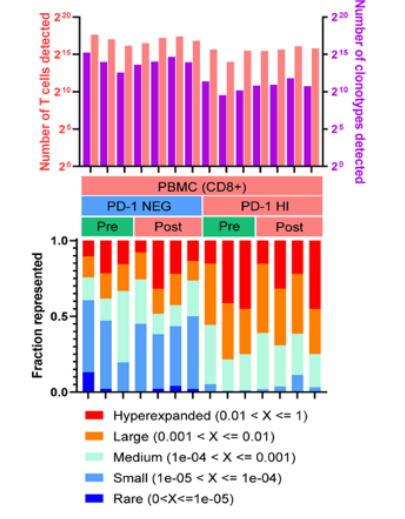
除了证实CD8+ T细胞亚型可以预测免疫治疗应答或抵抗外,另外一个重要的问题是响应免疫治疗的T细胞是来源于预先存在的肿瘤侵润淋巴细胞(TILs)的重新恢复,还是征募的新的T细胞。2019年一项Nature medicine上发表的研究利用sc-RNA测序和sc-TCR测序分析了11个基底细胞癌患者anti-PD1治疗前后的TILs[5]。结果发现了耗竭型CD8+ T细胞在治疗后最为显著性的增加,这些耗竭型CD8+ T细胞表达慢性活化、T细胞功能障碍和肿瘤反应性的基因。结合TCR测序发现了克隆扩增最多还是耗竭型CD8+ T细胞。然而对比分析治疗前和治疗后的T细胞克隆发现了治疗后绝大部分扩增的克隆在治疗前并不存在,说明了这些扩增的克隆是在治疗后新形成的。研究者最后还揭示了治疗后大约40%的TILs克隆可以在外周血中检测到,并且显著增加的也是耗竭型CD8+ T细胞。说明了组织中新的T细胞克隆很可能是来源于外周血。之后2020年Nature上的一项研究证实了免疫治疗后肿瘤组织和癌旁组织中存在共同克隆扩增的T细胞,并且在外周血中也同样存在[6]。
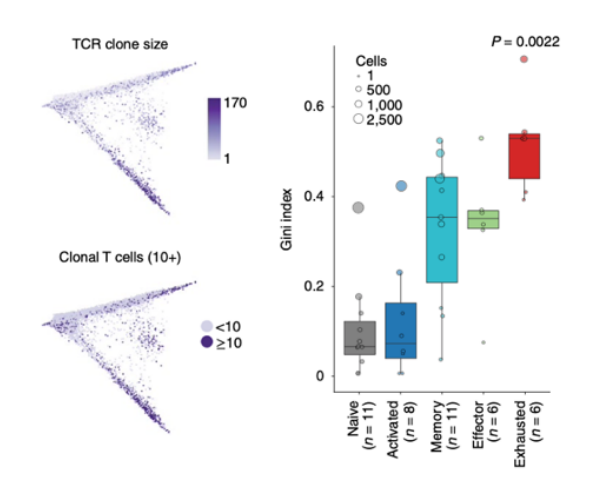
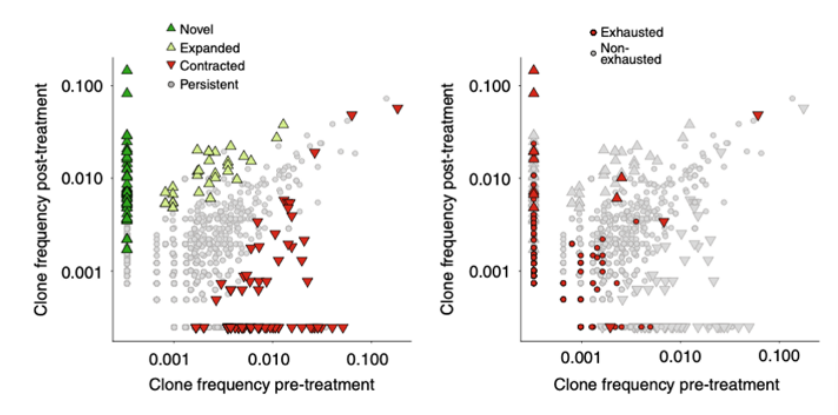
免疫治疗后耗竭型CD8+ T细胞具有最大的克隆扩增,并且是由新的克隆替代
那么这些外周血中克隆扩增的CD8+ T细胞是否也与免疫治疗预后具有显著相关性呢。Fairfax等人对55个黑色素瘤病人在anti-PD1或anti-PD1+CTLA4联合治疗前后的血液CD8+ T细胞进行了常规的转录组学分析,证实了很多编码TCR的基因在应答组中的表达显著高于无应答者[7]。并且在应答患者中存在更多的大的CD8+ T细胞克隆,大的CD8+ T细胞克隆越多的患者在治疗后的生存率越高。说明了外周血中克隆扩增的CD8+ T细胞可以作为免疫治疗的效果的预测标志物。
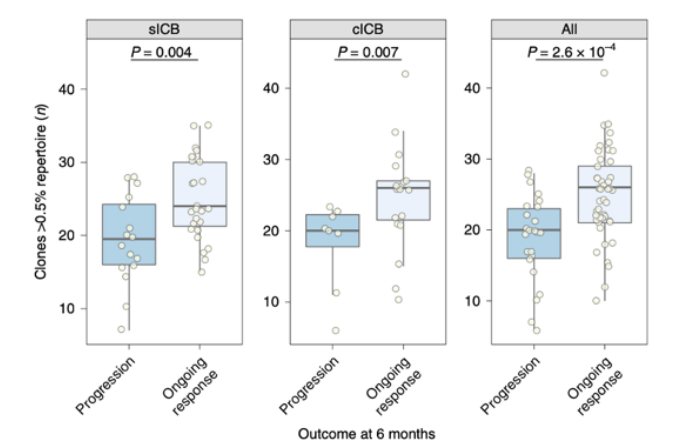
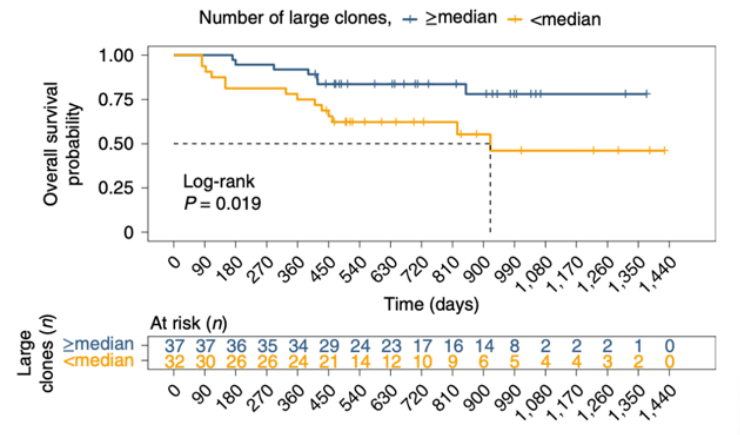
外周血中克隆扩增的CD8+ T细胞可以预测免疫治疗应答的标志物
就像上述的一些研究所述CD8+ T细胞的功能效应因子也与免疫治疗的效果具有显著相关性。功能障碍的CD8+ T细胞主要就是因为不能够产生效应因子(例如IFN-γ,TNF)和细胞毒分子(例如granzymes 和perforin),从而失去了杀死肿瘤细胞的能力。能够对免疫治疗后响应,说明了CD8+ T细胞分泌功能性因子的能力增加。因此,这些功能性细胞因子的分泌结合T细胞的变化或许可以更好的预测免疫治疗应答或抵抗。上述有项研究利用质谱流式检测了细胞因子,但是质谱流式检测的毕竟不是活细胞而且不是真正分泌出的细胞因子含量,所以需要更合适的技术检测单细胞的功能性蛋白(细胞因子)。很多研究通过sc-RNA测序结果中这些效应细胞因子的表达推测CD8+ T细胞的功能状态,但是转录水平的改变忽视了蛋白修饰和再加工的过程,已经有研究报告了耗竭型CD8+ T细胞有高表达mRNA但是几乎不表达蛋白或者细胞毒作用,所以必须谨慎的利用T细胞转录组数据推测其功能状态。如何突破单细胞功能蛋白组的瓶颈,实现真正意义上单细胞层面分泌蛋白组(细胞因子)的检测?去年Nat Rev Clin Oncol发表的一篇综述上提到了一项新的技术IsoPlexis单细胞功能蛋白组学[8],可以同时检测500-1500个活的单细胞分泌的32种细胞因子,对关键细胞亚型进行功能表征。
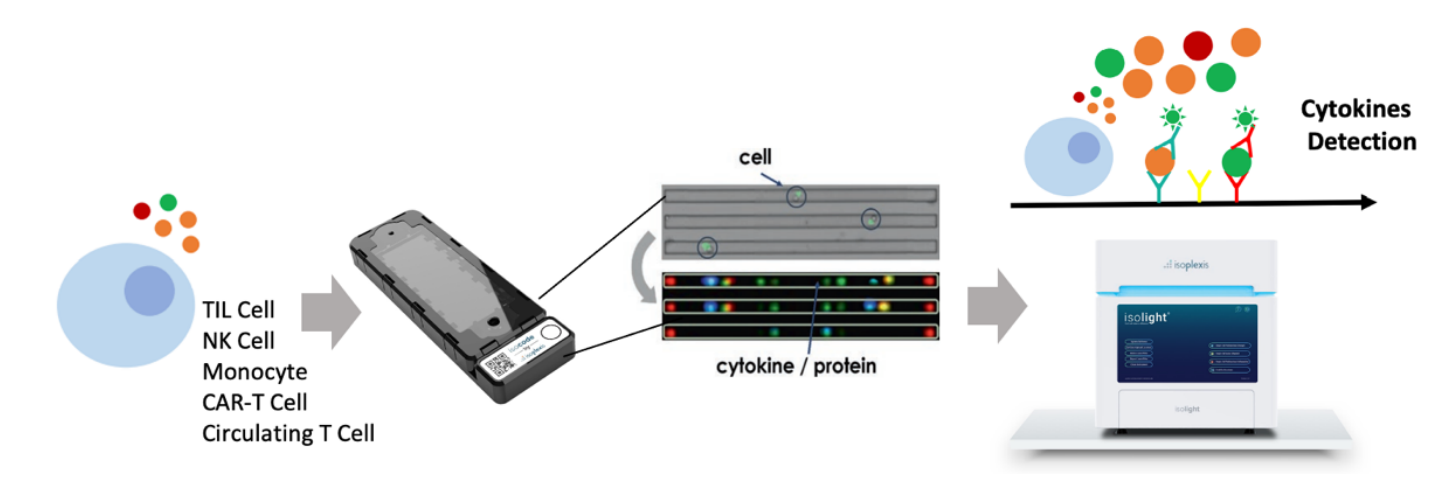
| IsoPlexis单细胞功能蛋白组
2020年发表在J Clin Oncol杂志上的一项研究就利用单细胞功能蛋白组学发现了CD8+ T细胞的多功能性可以作为NKTR-214(bempegaldesleukin)与Opdivo(nivolumab)免疫组合疗法的疗效预测标志物[9]。研究者分析了血液CD8+和CD4+ T细胞、NK细胞,只有多功能性CD8+ T细胞(分泌≥2个因子)的比例在客观缓解的患者一组中显著升高,在无应答的患者中并没有变化。这也与免疫检查点抑制主要影响CD8+ T细胞的结论相一致。在之后为期3年的研究中,研究者发现了CD8+ T细胞的多功能指数PSI(多功能性细胞比例x检测因子的信号强度)差异高的患者表现出更高的客观缓解率。这些结果说明了通过Isoplexis单细胞蛋白组分析得到的CD8+ T细胞多功能性指数PSI可成为与患者应答相关的预测性标志物。
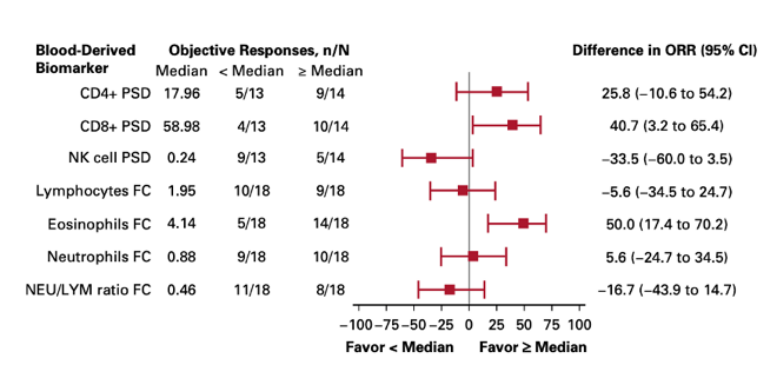
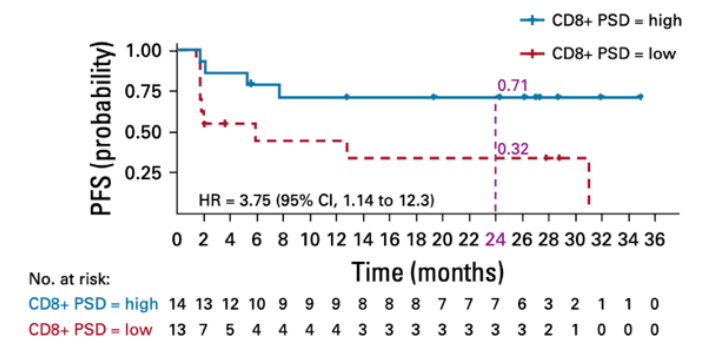
CD8+ T细胞PSI差异大的的患者免疫治疗后的客观缓解率高
外周血中CD8+ T细胞多功能指数PSI或许和T细胞的克隆扩增直接相关。Axelrod等人利用IsoPlexis分析了4个乳腺癌病人在新辅助化疗前后外周血中的PD1+和PD1-的CD4、CD8 T细胞[10]。结果发现在治疗后PD1+ CD8 T细胞的多功能性显著增加,通过对CD8 T细胞进行TCR测序分析发现治疗后克隆扩增最多的也是PD1+ CD8 T细胞,而不是PD1- CD8 T细胞。这就说明了IsoPlexis分析得到T细胞多功能性指数与克隆扩增具有直接相关性,是否可以反应克隆扩增的程度可能需要更多的研究数据来验证。
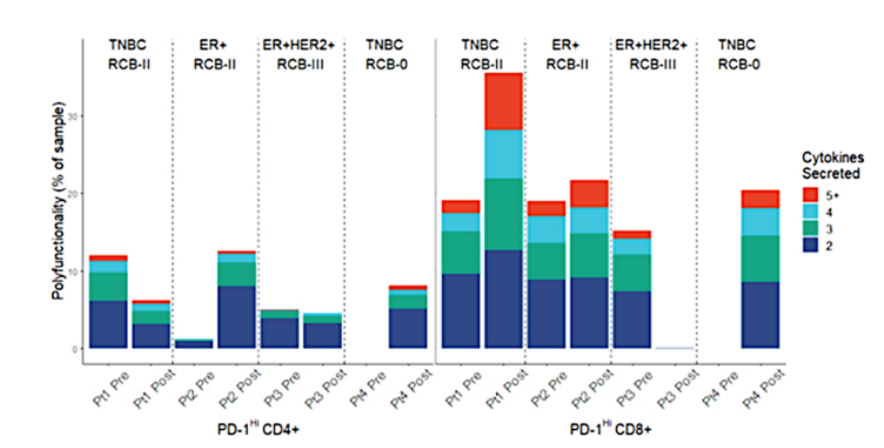
新辅助化疗前后PD1+ CD8 T细胞克隆和多功能性的变化
虽然免疫治疗主要发挥效应的是CD8+ T细胞,但是有研究已经发现了CD4+ T也可以支持免疫治疗反应。Abbas等人利用IsoPlexis分析了16名急性髓样淋巴瘤患者在anti-PD1治疗前后骨髓中的CD8+和CD4+ T细胞[11]。发现了应答患者中只有CD4+ T细胞的多功能指数PSI显著增加,与总生存率具有显著相关性。每个因子的贡献度分析揭示了IFN-γ和TNF-α是驱动CD4+ T细胞的多功能性增加的主要驱动因子。聚类分析也揭示效应性因子在应答患者CD4+ T细胞分泌的因子中占主导。
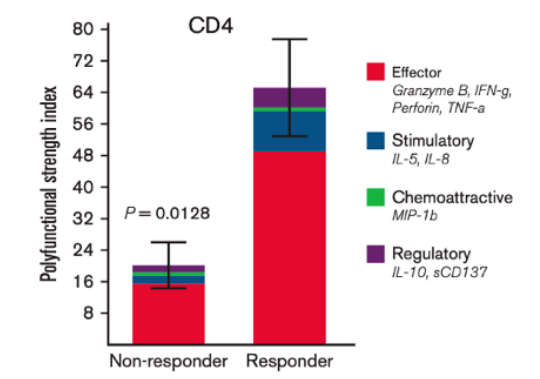
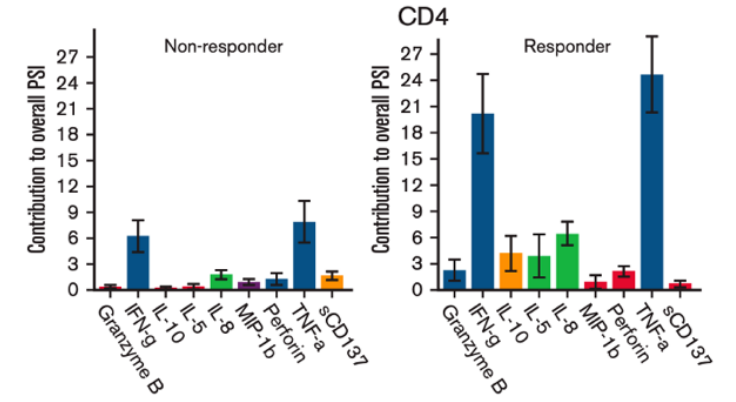
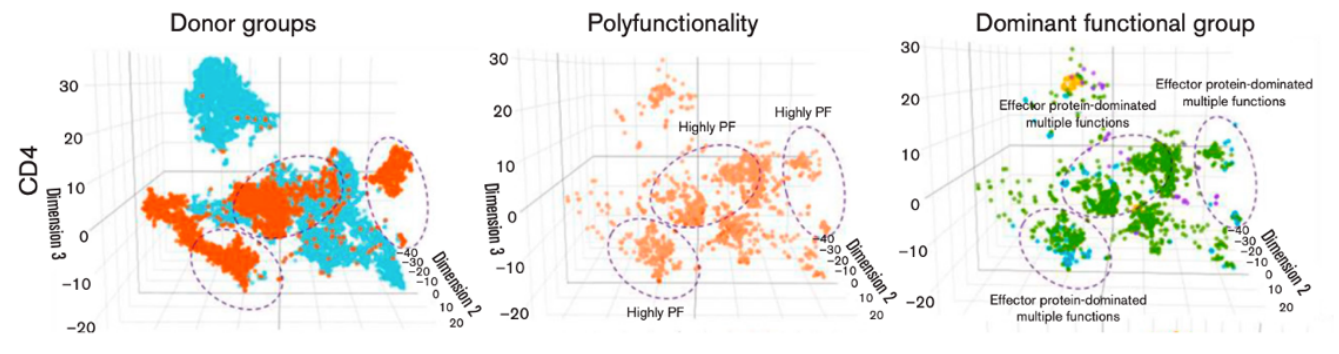
CD4+ T细胞的多功能性发生了改变
近期J Immunother Cancer杂质发表的一项临床2期试验中,同样利用IsoPlexis分析发现了血液中CD4+ T细胞的多功能性与免疫治疗具有显著相关性[12]。这项试验是临床转化标志物的研究,目的是为了预测anti-CTLA4或者联合anti-PD1治疗晚期黑色素瘤病人的应答。首先是通过CyTOF发现了应答患者中CD4+ T细胞在治疗后显著增加,并且主要是中央记忆性T细胞的增加,不是调节性T细胞。之后IsoPlexis进行功能表征分析,一致的,CD4+ T细胞的PSI在治疗后显著增加,并且主要是效应性因子的增加,调节性因子反而在应答患者中是下降的,这也与CyTOF的结果相一致。
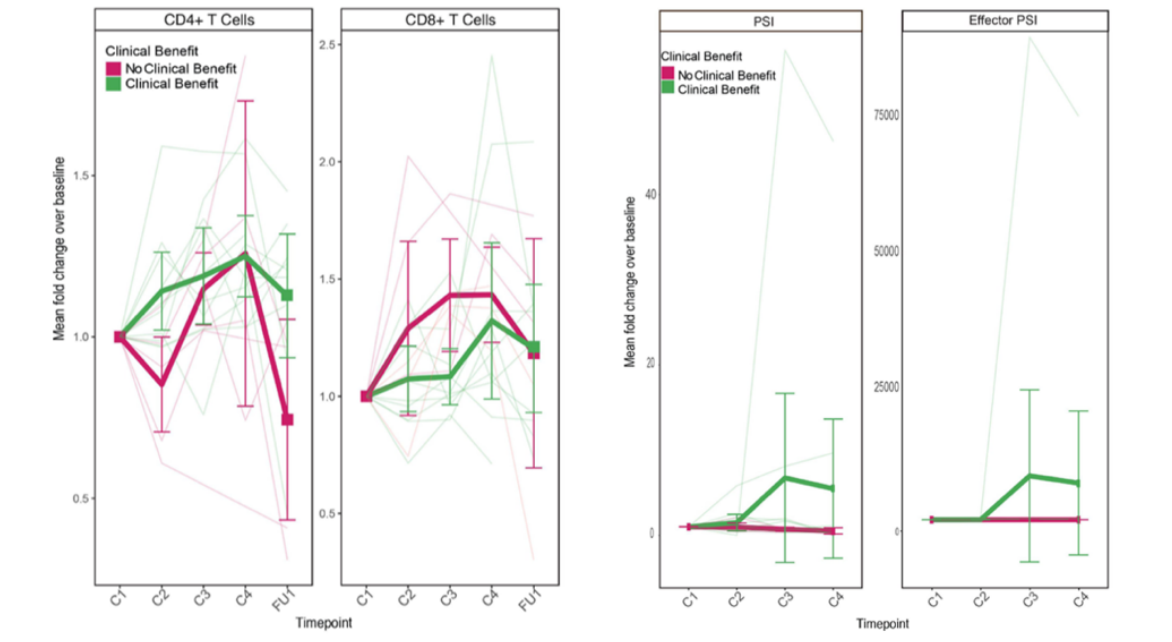
CyTOF和IsoPlexis联合分析发现CD4+ T细胞多功能性在免疫治疗后显著增加
对于靶向免疫抑制检查点治疗抵抗的病人,可以采用TIL的过继细胞疗法。Nature medicine上发表了一项临床1期试验,评估了TIL 过继细胞疗法处理anti-PD1治疗后疾病还进展的病人[13]。活性评估发现了69%(11/16)的病人发生了肿瘤消退。为了评估TIL 过继细胞疗法对体内T细胞功能的影响,研究者利用IsoPlexis分析了其中12名患者用药进程不同阶段血液中CD8+和CD4+ T细胞的多功能性。结果发现了TIL 过继细胞疗法主要是增加CD8+ T细胞的多功能性。同样的,流式细胞术分析也展示了TIL 过继细胞疗法主要增加的是效应性CD8+ T细胞。这说明了IsoPlexis分析得到的多功能性指数PSI与细胞表型相一致。
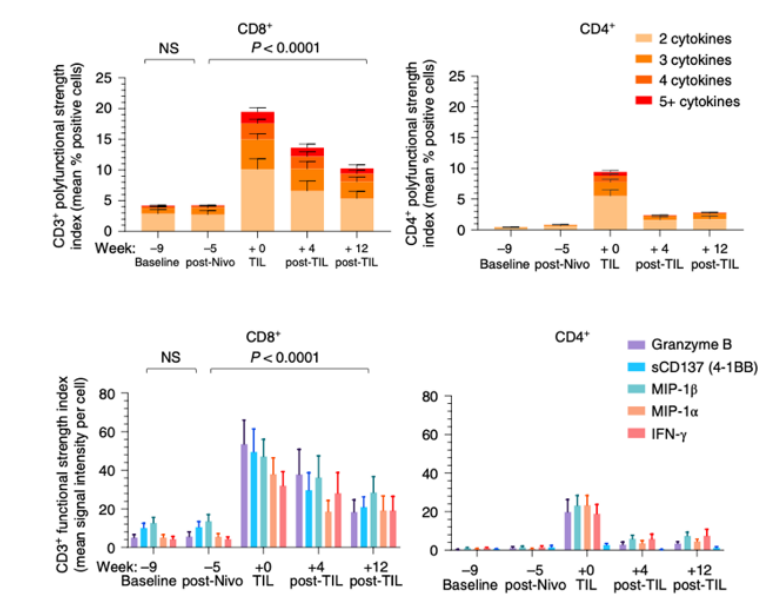
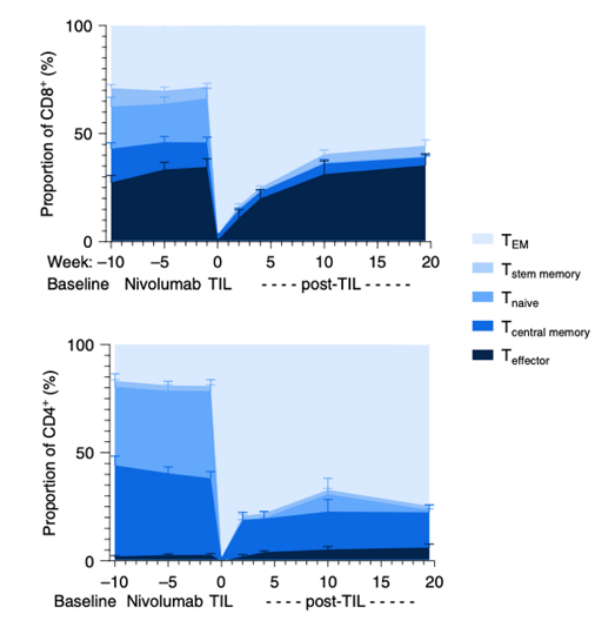
TIL 过继细胞疗法主要持续增加CD8+ T细胞的多功能性
在评估免疫细胞与肿瘤免疫治疗间的相关性上,研究的趋势已经从仅仅的细胞表型特征关联向细胞功能特征关联发展。IsoPlexis单细胞功能蛋白组学可以同时实现对500-1500单个细胞分泌的32种功能蛋白的检测,其提供的蛋白质组学功能层面的数据,与临床结果具有显著相关性。特别是在肿瘤免疫领域,对T细胞功能表征研究具有革命性的改变。

| 相关文献
1. Tumeh PC, Harview CL, Yearley JH, Shintaku IP, Taylor EJ, Robert L. PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature. 2014;515(7528):568-71.
2. Huang AC, Postow MA, Orlowski RJ, Mick R, Bengsch B, Manne S. T-cell invigoration to tumour burden ratio associated with anti-PD-1 response. Nature. 2017;545(7652):60-65.
3. Krieg C, Nowicka M, Guglietta S, Schindler S, Hartmann FJ, Weber LM et al. High-dimensional single-cell analysis predicts response to anti-PD-1 immunotherapy. Nat Med. 2018;24(2):144-153.
4. Sade-Feldman M, Yizhak K, Bjorgaard SL, Ray JP, de Boer CG, Jenkins RW et al. Defining T Cell States Associated with Response to Checkpoint Immunotherapy in Melanoma. Cell. 2018;175(4):998-1013.e20.
5. Yost KE, Satpathy AT, Wells DK, Qi Y, Wang C, Kageyama R et al. Clonal replacement of tumor-specific T cells following PD-1 blockade. Nat Med. 2019;25(8):1251-1259.
6. Wu TD, Madireddi S, de Almeida PE, Banchereau R, Chen YJ, Chitre AS. Peripheral T cell expansion predicts tumour infiltration and clinical response. Nature. 2020;579(7798):274-278.
7. Fairfax BP, Taylor CA, Watson RA, Nassiri I, Danielli S, Fang H et al. Peripheral CD8 + T cell characteristics associated with durable responses to immune checkpoint blockade in patients with metastatic melanoma. Nat Med. 2020;26(2):193-199.
8. Gohil SH, Iorgulescu JB, Braun DA, Keskin DB, Livak KJ. Applying high-dimensional single-cell technologies to the analysis of cancer immunotherapy. Nat Rev Clin Oncol. 2021;18(4):244-256.
9. Diab A, Tykodi SS, Daniels GA, Maio M, Curti BD, Lewis KD. Bempegaldesleukin Plus Nivolumab in First-Line Metastatic Melanoma et al. J Clin Oncol. 2021;39(26):2914-2925.
10. Axelrod ML, Nixon MJ, Gonzalez-Ericsson PI, Bergman RE, Pilkinton MA, McDonnell WJ et al. Changes in Peripheral and Local Tumor Immunity after Neoadjuvant Chemotherapy Reshape Clinical Outcomes in Patients with Breast Cancer. Clin Cancer Res. 2020;26(21):5668-5681.
11. Abbas HA, Sun H, Pierce SR, Kanagal-Shamanna R, Li Z, Yilmaz M et al. Single-cell polyfunctional proteomics of CD4 cells from patients with AML predicts responses to anti-PD-1-based therapy. Blood Adv. 2022 Apr:bloodadvances.2022007172.
12. Friedman CF, Spencer C, Cabanski CR, Panageas KS, Wells DK, Ribas Aet al. Ipilimumab alone or in combination with nivolumab in patients with advanced melanoma who have progressed or relapsed on PD-1 blockade: clinical outcomes and translational biomarker analyses. J Immunother Cancer. 2022;10(1):e003853.
13. Creelan BC, Wang C, Teer JK, Toloza EM, Yao J, Kim S et al. Tumor-infiltrating lymphocyte treatment for anti-PD-1-resistant metastatic lung cancer: a phase 1 trial. Nat Med. 2021;27(8):1410-1418.

地址:上海市闵行区绿洲环路396弄5幢4层
电话:400-869-2936,021-33968791
邮箱:support@wayenbiotech.com
传真:021-33938792
QQ:2120485725
战略合作
战略合作
| Full Moon | RayBiotech | CDI | IZON | Bio-Rad | R&D Systems | IsoPlexis | Akoya | 南模生物 | 欧易生物 | 上海实验动物研究中心 | 美吉生物 | 麦特绘谱 |
特别说明:本网所有网页均为华盈生物原创信息,转载必须征求华盈生物同意,并同时注明本网名称及网址。
专利代码